
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
分析 铁与盐酸反应生成氯化亚铁和氢气,铁与氯气反应生成氯化铁,生成的氢气和消耗的氯气体积相同(在相同条件下),说明氢气和氯气的物质的量相等,根据反应关系式Fe~H2、2Fe~3Cl2计算出消耗铁片的质量之比.
解答 解:生成的氢气和消耗的氯气体积相同(在相同条件下),说明生成氢气的物质的量相等,设生成气体的物质的量都是nmol,
铁片与盐酸反应生成氯化亚铁和氢气,反应的关系式为:Fe~H2,生成nol氢气消耗Fe的物质的量为nmol,质量为:56g/mol×nmol=56ng,
Fe与氯气反应生成氯化铁,反应的关系式为:2Fe~3Cl2,反应nmol氯气消耗Fe的物质的量为:nmol×$\frac{2}{3}$=1.5nmol,质量为:56g/mol×$\frac{2}{3}$nmol=$\frac{112}{3}$ng,
所以两片铁片的质量之比=56ng:$\frac{112}{3}$ng=3:2,
故选D.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应实质为解答关键,注意掌握关系式法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为20% | |
| B. | 某物质中只含有一种元素,则该物质一定是纯净物 | |
| C. | 只有一种元素的阳离子和一种元素的阴离子构成的物质一定是纯净物 | |
| D. | 盐形成的溶液中,既不能电离出H+,也不能电离出OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | <1:1 | C. | ≥1:1 | D. | 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
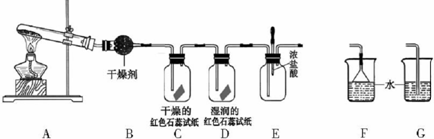
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质 Cl2、Br2、I2的氧化性强弱 | |
| B. | 气态氢化物 NH3、H2O、HF 的稳定性 | |
| C. | 碱金属单质 Li、Na、K 与水反应的剧烈程度 | |
| D. | 1mol Na、Mg、Al 分别与足量盐酸反应时失电子数的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入少量 HCl 气体 | B. | 加入少量 NaOH 固体 | ||
| C. | 加入少量 H2O | D. | 适当升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液 | B. | 硫酸氢钠溶液 | C. | 硫酸钾溶液 | D. | 硝酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com