
| A、FeCl3 |
| B、KCl |
| C、ZnCl2 |
| D、BaCl2 |
| 13.5g |
| 135g/mol |
| 35.5×2 |
| 64+35.2×2 |
| 35.5×3 |
| 35.5×3+56 |
| 35.5 |
| 35.5+39 |
| 35.5×2 |
| 35.5×2+65 |
| 35.5×2 |
| 35.5×2+137 |


科目:高中化学 来源: 题型:
| A、汽车尾气 |
| B、实验室做硝酸实验中排放的废气 |
| C、硫酸工业排放的废气 |
| D、家用液化气不完全燃烧的产生的废气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
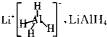 既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )
既是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈分解释放出H2,又知LiAIH4在125℃分解为LiH、Al和H2.下列有关说法正确的是( )| A、释放出H2的厦应都是放热反应 |
| B、LiAIH4中含有离子键、共价键 |
| C、LiAIH4与乙醛作用生成乙醇,LiAIH4作氧化剂 |
| D、LiAIH4在125℃分解,每转移2mol电子放出2.24L的H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
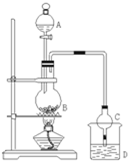 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
| 密度(g/cm3) | 0.714 | 0.789 | 1.049 | 0.903 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、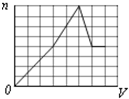 |
B、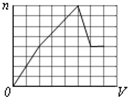 |
C、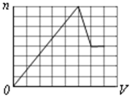 |
D、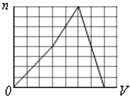 |
查看答案和解析>>
科目:高中化学 来源: 题型:
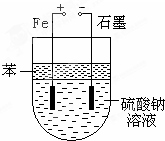 实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2mX | ||
B、
| ||
| C、10mx | ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com