(1)工业合成氨技术的反应原理是:N
2(g)+3H
2(g)
2NH
3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N
2、H
2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图1所示,回答下列问题:
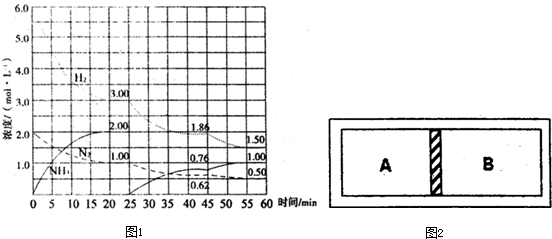
①计算反应在第一次平衡时平衡常数K=______(保留二位小数)
②产物NH
3在5~10min、20~25min和45~50min时平均反应速率[平均反应速率分别以v
1、v
2、v
3表示]从大到小排列次序为______.
③在45min时,采取的措施是______;
(2)如图2是一个体积固定的恒温密闭容器,正中间有一个可以滑动的隔板将容器隔成A、B两室.A室放入H
2和O
2共5mol,B室放入H
2和N
2共5mol,使隔板恰好处于正中间.
①控制一定条件,只使A室气体充分反应,此时隔板左移,待反应完成且密闭容器温度恒定(大于120℃)后,A室气体体积是B室体积的
.计算原H
2和O
2的体积比为______.
②再控制一定条件,使H
2和N
2发生反应(正反应放热).当密闭容器温度恒定(大于120℃)且达到平衡时,隔板右移恰好回到正中间,若加入的N
2为1mol,则N
2的转化率为______,若加入的N
2为xmol,则x的取值范围是______.




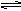 2NH3(g),N2、H2起始分别为10mol、30mol,达平衡时H2的转化率为25%,若从NH3开始反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时NH3的物质的量及NH3的转化率为( )
2NH3(g),N2、H2起始分别为10mol、30mol,达平衡时H2的转化率为25%,若从NH3开始反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时NH3的物质的量及NH3的转化率为( )  H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是 。
H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是 。