
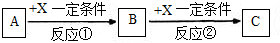
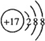
 ,故答案为:
,故答案为: ;
;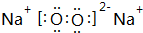 ,
, ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
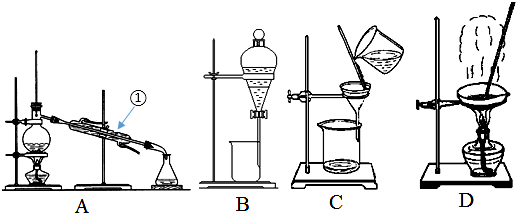
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
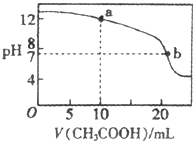 常温下有下列四种溶液:
常温下有下列四种溶液:| ① | ② | ③ | ④ | ||
| 溶液 | pH=4的NH4Cl | pH=4的盐酸 | 0.1mol?L-1的醋酸 | 0.1mol?L-1的NaOH | |
查看答案和解析>>
科目:高中化学 来源: 题型:
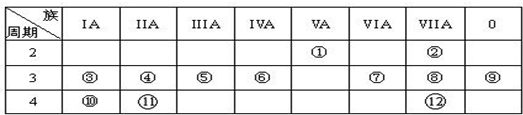
查看答案和解析>>
科目:高中化学 来源: 题型:
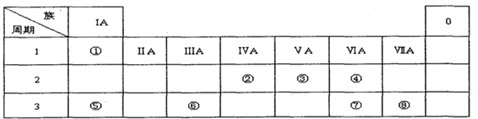
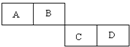 A、B、C、D四种短周期元素在周期表中的相对位置如图所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如图所示,A的单质与水蒸气反应可以制取水煤气.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,将铜放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中钝化 |
| B、浓硝酸在光照下变黄,证明硝酸不稳定,且产物有红棕色气体可溶于浓硝酸 |
| C、溴蒸气使湿润的碘化钾淀粉试纸变蓝,说明溴可与淀粉反应 |
| D、液氨是一种重要的制冷剂,说明氨气在液化时吸收大量的热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com