
| ||
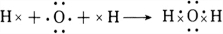 ,
, ;
;
| ||
| 1800g |
| 18g.mol |


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
| A、明矾的化学式:KAl(SO4)2 |
B、氯离子的结构示意图: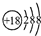 |
| C、2-丙醇的结构简式:(CH3)2CHOH |
D、溴化铵的电子式: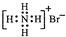 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省宿迁市五校高一上学期期中联考化学试卷(解析版) 题型:填空题
(10分)有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应的实验过程可用如图表示:
请回答下列问题:

(1)写出实验流程中下列物质化学式:试剂X ,沉淀A ,沉淀B 。
(2)①、②、③过程中均需要过滤,在进行此操作时需要用到的玻璃仪器为: 、 、 。
(3)上述实验流程中加入过量的Na2CO3的目的是 。
(4)按此实验方案得到的溶液3中肯定含有Na2CO3杂质;为了解决这个问题,可以向溶液3中加入适量的 ,之后若要获得固体NaNO3需进行的实验操作是 (填操作名称)。
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省蚌埠市高一上学期期中化学试卷(解析版) 题型:选择题
用自来水养金鱼之前,一般要把水放在阳光下曝晒一段时间。其目的是
A、除去次氯酸 B、提高水温
C、增加水中氧气的含量 D、利用紫外线杀菌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com