
����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g��CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ�����
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ= ��
��2���÷�ӦΪ��Ӧ��ѡ�����ȡ����ȣ���
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��c��H2��=c��CO��c��H2O�������жϴ�ʱ���¶�Ϊ�森
��4����1200��ʱ����ijʱ��ƽ����ϵ��CO2��H2��CO��H2O��Ũ�ȷֱ�Ϊ2molL��1��
2molL��1��4molL��1��4molL��1 �� ���ʱ������Ӧ��ƽ���ƶ�����Ϊ �� ��ѡ�����Ӧ�������淴Ӧ���������ƶ�����
���𰸡�
��1��![]()
��2������
��3��830
��4���淴Ӧ����
���������⣺��1��ƽ�ⳣ������������Ũ����֮�����Է�Ӧ��Ũ����֮������K= ![]() ��
��
���Դ��ǣ� ![]() ��
��
��2���¶�����ƽ�ⳣ������˵��ƽ��������Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ�����Դ��ǣ����ȣ�
��3����c��CO2��c��H2��=c��CO��c��H2O������֪k= ![]() =1.0���¶�Ϊ730�棬
=1.0���¶�Ϊ730�棬
���Դ��ǣ�830��
��4����1200��ʱK=2.6��ijʱ��ƽ����ϵ��CO2��H2��CO��H2O��Ũ�ȷֱ�Ϊ2molL��1��2molL��1��4molL��1��4molL��1��Qc= ![]() =4��K��˵��ƽ�������ƶ�������ʱ������Ӧ��ƽ���ƶ�����Ϊ�淴Ӧ����
=4��K��˵��ƽ�������ƶ�������ʱ������Ӧ��ƽ���ƶ�����Ϊ�淴Ӧ����
��Ϊ���淴Ӧ����
�����㾫�������ڱ��⿼��Ļ�ѧƽ��ļ��㣬��Ҫ�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%���ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������з�Ӧ�У�HCl�����������ǣ�������
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2��
C.MnO2+4HCl��Ũ�� ![]() MnCl2+2H2O+Cl2��
MnCl2+2H2O+Cl2��
D.CuO+2HCl=CuCl2+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ�ӹ��ɵĴ���� ��
A.һ���ǻ�����
B.�����ǵ��ʣ�Ҳ�����ǻ�����
C.һ���ǵ���
D.һ����ͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֱ�������в�����������ó��Ľ�����ȷ������ ��
ѡ�� | ���� | ���� | ���� |
A | �μ�Ba��NO3��2��HNO3�����Һ | ���ɰ�ɫ���� | ԭ��Һ����SO42- |
B | ����ϩͨ����ˮ�� | ��ˮ��ɫ | ��ϩ����ˮ����������Ӧ |
C | �ֱ�������Ͷ�뵽ʢ��ˮ���Ҵ����ձ��� | ʢˮ�ձ��з�Ӧ���� | ˮ�е�����Ҵ��е��������ǿ |
D | �μ�NaOH��Һ����ʪ���ɫʯ����ֽ�����Թܿ� | ��ֽ������ | ԭ��Һ����NH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ֳ����ĵ��ʣ��ҡ���Ϊ��ѧ�����Ļ�����ס��ҡ���������Ԫ�� X �����������µ�ת����ϵ�����ֲ��P��Ӧ��������ȥ���������ж���ȷ����:
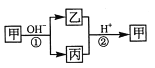
A�� XԪ�ؿ���ΪAl B�� X Ԫ�ز�һ��Ϊ�ǽ���Ԫ��
C����Ӧ��������Ϊ���淴Ӧ D����Ӧ������һ��Ϊ������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ�Ļ�����У�����һ������ϡ���ᣬʹ֮��ַ�Ӧ��ʣ�����m1g���������м���һ������ϡ���ᣬ�����ʣ�����m2 g����m1��m2��ϵ�ǣ� ��
A.m1һ������m2
B.m1������m2
C.m1���ܵ���m2
D.m1һ������m2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Q��R��X��Y��ZΪ���ڱ���ԭ���������ε�����ǰ������Ԫ�ء���֪:
�� QΪԪ�����ڱ���ԭ�Ӱ뾶��С��Ԫ��;
�� R�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ��,��ÿ�ֹ���еĵ���������ͬ;
�� Y�Ļ�̬ԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3��;
�� Z�С����������֮��,Z4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ��
��ش���������(����ʱ,Q��R��X��Y��Z������Ӧ��Ԫ�ط��ű�ʾ):
(1)Q��R��Y����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к�����,������M�Ŀռ乹��Ϊ____________,������ԭ�Ӳ�ȡ_______�ӻ�;Q��R����Ԫ����ɵ�ԭ�Ӹ�����Ϊ1:1�Ļ�����N����ѧ��ѧ�г������л��ܼ�,������N�ڹ�̬ʱ�ľ�������Ϊ____��
(2)R��X��Y����Ԫ�صĵ�һ��������С�����˳��Ϊ________________��
(3)������һ�ֻ����Ԫ����ɵ���RY2��Ϊ�ȵ�����ķ���Ϊ_____(д����ʽ)��
(4)��R��X��Y����Ԫ����ɵ�RXY-���������������¿���NaClO��Һ��Ӧ,����X2��RY2������,�÷�Ӧ�����ӷ���ʽΪ_________________________��
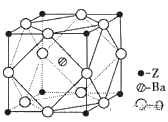
(5)ij��Z�����,��ѧʽΪ[ZCl(H2O)5]Cl2, ��λ��Ϊ____��1 mol���������![]() ������ĿΪ___��
������ĿΪ___��
(6)Zԭ�ӻ�̬ʱ�ļ۵����Ų�ʽΪ__________;��֪Z��һ�ֺ����ᱵ�ε��ܶ�Ϊ�� g.cm-3,�侧���Ľṹ��ͼ��ʾ,��������ԭ���뱵ԭ�ӵ��������Ϊ_______cm��(ֻҪ������ʽ,���ؼ������ֵ������٤������ΪNA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к���Cl����CO32����SO42�����������ӣ����ֻȡһ����Һ���ֱ��������Ӽ�����������м����Լ�����˳��(��������)��ȷ���ǣ� ��
A.�Ȼ�����Һ�����ᡢ��������ҺB.���ᡢ��������Һ���Ȼ�����Һ
C.���ᡢ���ᱵ��Һ����������ҺD.ϡ���ᡢ���ᱵ��Һ����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��θҩ��ֹ���Ϊ̼��ƣ��ⶨÿƬ��̼��ƺ����ķ��������¼�����������ҩƬ�е������ɷֲ���������������Ʒ�Ӧ����
������0.100molL��1ϡ�����0.100molL��1����������Һ��
��ȡһ��ҩƬ��ҩƬ������ͬ����Ϊ0.100g������������20.0mL����ˮ
���Է�̪Ϊָʾ������0.100molL��1����������Һ�ζ�����ȥ���ΪVʱ�ﵽ�յ�
�ܼ���25.00mL 0.100molL��1ϡ���ᣮ
��ش���������
��1���ⶨ���̵���ȷ����˳��Ϊ��������ţ���
��2���ⶨ�����з�����Ӧ�����ӷ���ʽΪ�� ��
��3����ij��ʵ�����ظ��ⶨ4�Σ�ʵ��������50mL��100mL��250mL��500mL���ֹ�������ƿ��������ϡ����Ӧѡ�õ�����ƿ������Ϊ �� ������ ��
��4��ijͬѧ�Ĵβⶨ��V���������
�ⶨ���� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
�������λͬѧ��ʵ�����ݣ�����ҩƬ��̼��Ƶ��������� ��
��5������ʵ�����������������ƫ�͵��� ��
������ƽ����NaOH���壬��С�ձ��������̣�����������̣����ƶ����룬ʹ֮ƽ�⣮
�ڵζ�ǰ�ζ��ܼ��������ݣ��ζ������������ʧ ���к͵ζ�ʱ����ƿ������������ˮ���ܵζ���������ˮϴ��δ�ñ�Һϴ�� �ݶ�ȡ�ζ����յ����ʱ�����ӿ̶��ߣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com