
【题目】下列有关胶体的说法中正确的是( )
A.夏日的傍晚常常看到万丈霞光穿云而过,美不胜收,这与胶体性质有关
B.浊液、胶体和溶液的最根本的区别是能否发生丁达尔效应
C.采用过滤法,可将![]() 胶体中的
胶体中的![]() 杂质除去
杂质除去
D.向三氯化铁溶液中滴入氢氧化钠溶液可制得![]() 胶体
胶体
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种耐高温、抗冲击、导电性好的优良工业材料。现通过反应:Al2O3+3C+N2![]() 2AlN+3CO来制取,下列有关该反应的说法中正确的是
2AlN+3CO来制取,下列有关该反应的说法中正确的是
A.Al2O3中Al元素化合价没有发生变化B.N2是氧化剂
C.CO作还原剂D.反应物C发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)4.8gO3和0.2molCH4,在同温同压下的体积之比是__;相同质量的O2和SO2,所含分子的数目之比为__,所含O原子的物质的量之比为__,密度之比为__。
(2)标准状况下11.2 L N2所含分子数是___个。
(3)若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是__g。
(4)483g Na2SO4·10H2O中所含的Na+的物质的量是__,SO42-的物质的量是__,所含H2O分子的数目是___个。
(5)现有100 ml 1.00 mol/L NaCl溶液,其中所含Na+的质量是___g。
(6)下列物质能导电是__,属于电解质是__,属于非电解质的是__。(填序号,多选或错选扣分)①水银 ②烧碱 ③硫酸钡 ④氯化钠晶体 ⑤盐酸 ⑥蔗糖
(7)实验室配制480mL0.08mol/LNa2CO3溶液,需要十水碳酸钠晶体质量_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空

(1)A的结构简式是____________________
(2)①的反应类型是_________________。③的反应类型是__________________。
(3)反应④的化学方程式是 ____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中A、B属于盐,C属于碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为___。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为___,该反应的离子方程式为___。
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为___,鉴别溶液中B的阴离子的试剂为___。
②D溶于稀硝酸的离子方程式为___。
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为VL,则E在混合物中的质量分数的表达式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:
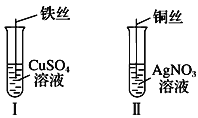
①Ⅰ中发生反应的离子方程式为______________;
②Ⅱ中铜丝上观察到的现象是_____________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为________。
(2)黑火药爆炸时发生反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,其中被还原的元素是__,被氧化的元素是____,氧化剂是____,还原剂是__,氧化产物是____,还原产物是_____。
(3)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中氧化产物是_____;若反应中转移了0.3 mol电子,则还原产物的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有Na2SO4、NaHCO3的NaCl固体提纯,制得纯净的氯化钠溶液,某学生设计了如下图所示的实验方案:

已知碳酸氢钠在加热条件下能分解成碳酸钠、二氧化碳和水,而NaCl和Na2SO4固体加热时不发生化学变化。请回答下列问题:
(1)操作①盛放药品可选用___________(填仪器名称)。
(2)操作②为什么不用Ba(NO3)2溶液,其理由是:___________________________。
(3)进行操作②后,判断SO42-已除尽的方法是:______________________________。
(4)操作③的目的是:____________________________________________________。
(5)此设计方案是否严密___________(填“是”或“否”)理由_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的CO和CO2相比,下列叙述中正确的是
A.所含碳原子数比为1:1 B.体积比为7:11
C.密度比为7:11 D.分子数比为7:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是盛放浓硫酸试剂瓶标签上的部分内容。现用该浓硫酸配制240 mL 1.0 mol·L-1的稀硫酸。请回答下列问题:

(1)配制上述稀硫酸时,可供选用的仪器有:①玻璃棒;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦胶头滴管。还缺少的仪器有______________(写仪器名称);
(2)容量瓶上除有刻度线外还应标有____________,在使用前必须检查容量瓶是否____________。
(3)配制240 mL 1.0 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸,量取浓硫酸时应选用以下_____规格的量筒(填选项)。
A.10 mL B.25 mL C.50 mL D.100 mL
(4)配制过程有以下操作:
A.移液 B.量取 C.洗涤 D.定容 E.稀释 F.摇匀 G.计算
其正确的操作顺序应是______________(填序号)。
(5)经过测定,某同学配制的稀硫酸浓度偏低,则可能的原因是_______(填序号)
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③洗涤烧杯内壁和玻璃棒后将洗涤液倒入废液缸
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥摇匀后发现溶液的凹液面低于刻度线,再加蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com