
| A. | 浓度、温度、压强、催化剂既是影响反应速率的因素又是影响反应限度的因素 | |
| B. | 合成氨反应在一定条件下达到平衡后,N2、H2、NH3物质的量之比保持恒定 | |
| C. | 化学反应的限度决定于反应物的性质,与外界条件无关 | |
| D. | 增大反应物的用量一定会加快反应速率 |
分析 A.化学反应限度就是研究可逆反应所能达到的最大程度;
B.达到平衡状态时,各物质的含量保持不变;
C.化学反应限度就是研究可逆反应所能达到的最大程度;
D.若反应物为固体,增大用量,对反应速率无影响.
解答 解:A.化学反应限度就是研究可逆反应所能达到的最大程度,故浓度、温度、压强、催化剂是影响反应速率的因素,不是影响反应限度的因素,故A错误;
B.达到平衡状态时,各物质的含量保持不变,故合成氨反应在一定条件下达到平衡后,N2、H2、NH3物质的量之比保持恒定,故B正确;
C.化学反应限度就是研究可逆反应所能达到的最大程度,故化学反应的限度决定于反应物的性质,外界条件改变平衡发生移动,与外界条件有关,故C错误;
D.若反应物为固体,增大用量,对反应速率无影响,故D错误;
故选B.
点评 本题考查化学反应限度的概念及影响因素、化学平衡状态的特征、化学反应速率的影响因素等,难度不大.要注意基础知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
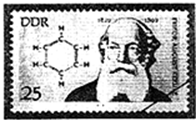 人们对苯的认识有一个不断深化的过程.
人们对苯的认识有一个不断深化的过程.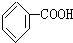 )和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与NaOH共热生成苯的化学方程式:
)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与NaOH共热生成苯的化学方程式: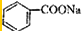 +NaOH$→_{△}^{氧化钙}$Na2CO3+
+NaOH$→_{△}^{氧化钙}$Na2CO3+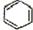 .
.
 )脱
)脱查看答案和解析>>
科目:高中化学 来源: 题型:解答题
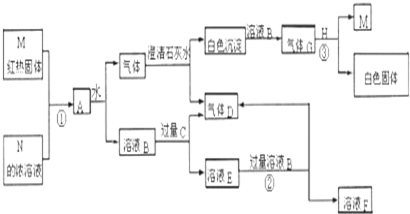
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
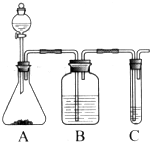 Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质
Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
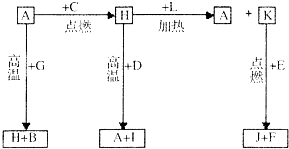 A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色无味的液体,H是黑色固体.以上物质相互间的转化关系如图所示,请回答下列问题:
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色无味的液体,H是黑色固体.以上物质相互间的转化关系如图所示,请回答下列问题: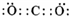 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
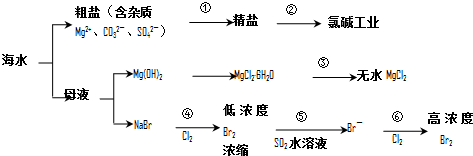
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗2.24LCl2 | |
| D. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com