
【题目】某化学兴趣小组为探究元素性质的递变规律,设计如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,____与盐酸反应最慢。
Ⅱ. 利用如图装置可以验证非金属性的变化规律。
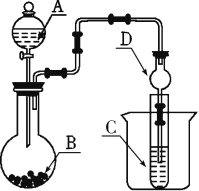
(2)仪器A的名称为_______,干燥管D的作用是_____。
(3)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为___、___、.____,装置C中的实验现象为有黄色沉淀生成,离子方程式为__________________。
(4)若要证明非金属性:S>C>Si,则A中加____,B中加Na2CO3,C中加_____,观察到C中溶液的现象为_____________________________________________________。
【答案】钾 铝 分液漏斗 防止倒吸 浓盐酸 KMnO4 Na2S S2-+Cl2=S↓+2Cl- 稀硫酸 Na2SiO3溶液 有白色沉淀产生
【解析】
I.(1)同一周期元素,金属性随着原子序数增大而减弱,同一主族,原子序数越大,金属性越强,元素的金属性越强,其单质与酸或水反应越剧烈,所以金属性K>Na>Mg>Al,则钾与盐酸反应最剧烈,铝与盐酸反应最慢,故答案为:钾;铝;
Ⅱ.(2)仪器A为分液漏斗,球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,故答案为:分液漏斗;防止倒吸;
(3)要验证氯的非金属性大于硫的;可以通过氯气和硫化钠反应置换出单质硫来证明,由于制取氯气时没有加热,选择高锰酸钾与浓盐酸反应制氯气,故装置A、B、C中所装药品分别为浓盐酸、 KMnO4、 Na2S ;装置C中的实验现象为有黄色沉淀生成,离子方程式为S2-+Cl2=S↓+2Cl-,故答案为:浓盐酸;KMnO4;Na2S ;S2-+Cl2=S↓+2Cl-;
(4)若要证明非金属性:S>C>Si,可通过实验证明S、C、Si的最高价含氧酸酸性依次减弱判断;通过硫酸制备二氧化碳,二氧化碳和硅酸钠溶液反应生成难溶性的硅酸来证明,故A中可以加稀硫酸,通过稀硫酸和碳酸钠的反应来制取CO2,然后将生成的CO2通入C中的Na2SiO3溶液中,可以发生反应:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3,离子反应为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,产生白色胶状沉淀,从而可以证明酸性:H2SO4>H2CO3>H2SiO3,故答案为:稀硫酸; Na2SiO3溶液;有白色沉淀产生。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | ⑾ | ⑿ | ⒀ | ||||
(1) 表中元素______的非金属性最强;元素______的金属性最强;元素______的单质室温下呈液态(填写元素符号);
(2) 表中元素⑿的原子结构示意图是___________;
(3) 表中元素⑤在周期表中的位置为____________________;
(4) 表中元素⑨和⑩最高价氧化对应水化物的酸性:__________>__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 叫狄尔斯阿德而反应,用于构建六元环,则下列说法不正确的是
叫狄尔斯阿德而反应,用于构建六元环,则下列说法不正确的是
A. 狄尔斯阿德而反应为加成反应,原子利用率为100%
B. ![]() 可通过狄尔斯阿德而反应合成,而
可通过狄尔斯阿德而反应合成,而 不可通过狄尔斯阿德而反应合成
不可通过狄尔斯阿德而反应合成
C. 2-甲基-1,3-丁二烯和丙炔发生上述反应产物有两种
D. ![]() 可由环戊二烯与丙烯酸甲酯发生上述反应得到
可由环戊二烯与丙烯酸甲酯发生上述反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中,下列电离方程式正确的是
A.Al2(SO4)3=2Al3++3SO42-
B.AlCl3=Al3++Cl3-
C.Mg(NO3)2=Mg+2+2NO3-
D.KMnO4=K++Mn7++4O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关键环节题组
I.以淀粉和油脂为原料,制备生活中某些物质。
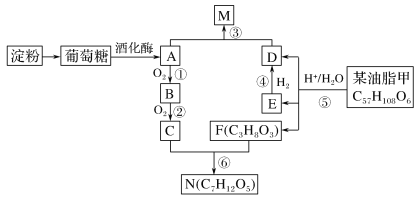
已知:反应⑤生成D、E、F的物质的量之比为2∶1∶1,E与等物质的量H2反应。
请回答:
(1) 写出N的所有可能的结构简式______________________________________
(2) 写出反应③(A+D→M)的化学方程式:_______________________________
II.酚醛树脂是一种合成塑料,线型酚醛树脂可通过如下路线合成:
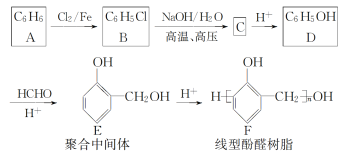
回答下列问题:
(1) B生成C的化学方程式为___________________________________,反应类型为_____。
(2) D生成E的反应类型是________,若D与HCHO按物质的量比1∶3发生类似反应,则生成另一种聚合中间体的结构简式为________________。
(3) E的同分异构体中,属于二元酚的共有________种,其中核磁共振氢谱有四组吸收峰,且峰面积比为3∶2∶2∶1的是______________(写出其一种的结构简式)。
(4) 尿素[CO(NH2)2]分子中氮原子上的氢原子可以像苯环上的氢原子那样与甲醛发生类似D→E→F的反应,则生成线型脲醛树脂的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如下装置用于制取SO2和验证SO2的性质。
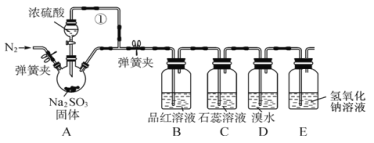
试回答以下问题:
(1)装置A 中用于添加浓硫酸的仪器名称为____,其中反应的化学方程式为________。
(2)导管①的作用是________。
(3)装置D中可观察到的现象是_______,体现出 SO2 ______性。
(4)E装置的作用是_______,发生反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按右图装置进行制取。

A B C D E
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要_____(填仪器名称);装置C的作用是_____________________。
(2)B中产生ClO2的化学方程式______________________________________。
(3)装置D中反应生成NaClO2的化学方程式为____________________________ 。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有的一种阴离子是_________,检验该离子的方法是___________________________。
(4)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②______________;③______________;④______________;得到成品。
(5)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________;
实验Ⅱ:样品杂质分析与纯度测定
(6)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。
取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是__________________________________________________。
②所称取的样品中NaClO2的物质的量为______________mol(用含c、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com