
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),pc(CO32-)=-lgc(CO32-).下列说法正确的是BD.
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),pc(CO32-)=-lgc(CO32-).下列说法正确的是BD.分析 A.pM相等时,图线中pc(CO32-)数值越大,实际浓度越小;
B.a点可表示MnCO3的饱和溶液,pM=p(CO32-);
C.b点可表示CaCO3的饱和溶液,pM<p(CO32-);
D.pM数值越大,实际浓度越小,则c点可表示MgCO3 的不饱和溶液,pM>p(CO32-).
解答 解:A.pM相等时,图线中p(CO32-)数值越大,实际浓度越小,因此,MgCO3、CaCO3、MnCO3 的Ksp依次减小,故A错误;
B.a点可表示MnCO3的饱和溶液,pM=p(CO32-),所以c(Mn2+)=c(CO32-),故B正确;
C.b点可表示CaCO3的饱和溶液,pM<p(CO32-),所以c(Ca2+)>c(CO32-),故C错误;
D.pM数值越大,实际浓度越小,则c点可表示MgCO3 的不饱和溶液,pM>p(CO32-),所以c(Mg2+)<c(CO32-),故D正确;
故选BD.
点评 本题主要考查了沉淀溶解平衡曲线,题目难度中等,掌握图线中pc(CO32-)、pM数值越大,实际浓度越小是解题的关键,注意掌握难溶物溶解平衡及其影响,试题培养了学生的分析能力及灵活应用能力.


 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
 ,关于该有机物下列叙述不正确的是( )
,关于该有机物下列叙述不正确的是( )| A. | 能使溴水褪色 | |
| B. | 一定条件下,能和NaOH醇溶液反应 | |
| C. | 在加热和催化剂作用下,最多能和4 mol H2发生加成反应 | |
| D. | 能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、CO、O2、CaO | B. | O2、CO、CO2、CaCO3 | C. | O2、CO2、CO、CaCO3 | D. | CO、CO2、O2、Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在燃煤时加入石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO4+2CO2 | |
| B. | 用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 | |
| D. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++PbS═CuS+Pb2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
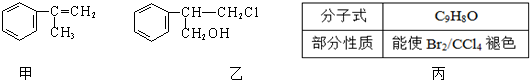
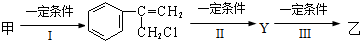
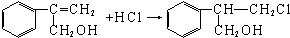 (不需注明反应条件).
(不需注明反应条件).
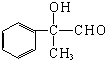 ;丙的结构简式为
;丙的结构简式为 .
. 、
、 、
、 其中一种.
其中一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 反应②的条件是氢氧化钠水溶液、加热
反应②的条件是氢氧化钠水溶液、加热

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com