
分析 二氧化碳的物质的量为$\frac{22g}{44g/mol}$=0.5mol、水的物质的量为$\frac{9g}{18g/mol}$=0.5mol,根据质量守恒可知,15gA中氧元素质量为15g-0.5mol×12g/mol+0.5mol×2×1g/mol=8g,则n(O)=$\frac{8g}{16g/mol}$=0.5mol,故有机物A分子中N(C):N(H):(O)=0.5mol:1mol:0.5mol=1:2:1,A的最简式为CH2O;若A是一种无色具有强烈刺激气味的气体,具有还原性,则A为甲醛;若A的质谱图中最大荷质比为60,分子式为C2H4O2,对应的同分异构体可为乙酸、甲酸甲酯或羟基乙醛等.
解答 解:二氧化碳的物质的量为$\frac{22g}{44g/mol}$=0.5mol、水的物质的量为$\frac{9g}{18g/mol}$=0.5mol,根据质量守恒可知,15gA中氧元素质量为15g-0.5mol×12g/mol+0.5mol×2×1g/mol=8g,则n(O)=$\frac{8g}{16g/mol}$=0.5mol,故有机物A分子中N(C):N(H):(O)=0.5mol:1mol:0.5mol=1:2:1,A的最简式为CH2O,
若A是一种无色具有强烈刺激气味的气体,具有还原性,则A为甲醛,结构简式为HCHO,水溶液为福尔马林;
若A的质谱图中最大荷质比为60,分子式为C2H4O2,对应的同分异构体可为乙酸、甲酸甲酯或羟基乙醛等,有3种同分异构体,
故答案为:CH2O;福尔马林;C2H4O2;3.
点评 本题考查了有机物实验式和结构简式的确定,正确确定A的实验式是解本题关键,结合A的性质确定A中含有的官能团,结合A的实验式确定其结构简式,难度中等.


科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).
; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).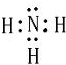 ;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).
;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质都能在氧气中燃烧生成过氧化物 | |
| B. | N、O、F氢化物的稳定性依次减弱 | |
| C. | P、S、Cl最高正价依次升高 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃都是无色、难溶于水,比水重的液体 | |
| B. | 所有卤代烃在适当条件下都能发生取代反应 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 氟氯代烷(即氟利昂)是优良的制冷剂、灭火剂,需推广使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
.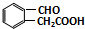 或
或 (任写一种).
(任写一种).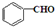 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题:
Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题: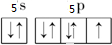 ,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;
,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)相等的NH4Cl溶液中的c(Cl-)大于(NH4)2Fe(SO4)2溶液中c(SO42-) | |
| B. | 常温下,pH=1的醋酸与pH=13的NaOH 溶液混合后的溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中 2c(Na+)═3c(CO32-)+3c(HCO3-) | |
| D. | 稀释氯化铵溶液过程中,NH4+的水解程度和水的电离程度都增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com