
分析 同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,电荷的分布是不均匀的,不对称的,为极性分子,正负电荷的重心重合,电荷分布均匀,则为非极性分子,以离子键结合形成的晶体为离子晶体,以共价键结合形成的空间网状晶体为原子晶体,结合成键微粒分析熔沸点高低,以此解答该题.
解答 解:由极性键形成的非极性分子有CO2,
由非极性键形成的非极性分子有H2,
能形成分子晶体的物质是H2、CO2、HF,
含有氢键的晶体的化学式是HF,
属于离子晶体的是(NH4)2SO4,
属于原子晶体的是SiC,
一般地,熔点高低顺序为:原子晶体>离子晶体>分子晶体,原子晶体中共价键键长越短,将能越大,熔沸点越高;离子晶体中离子的半径越小、所带电荷数越多,离子键越强,熔沸点越高;分子晶体中,形成分子间氢键会使物质的熔沸点反常的升高,组成和结构相似的相对分子质量越大,熔沸点越高,故五种物质的熔点由高到低的顺序是SiC>(NH4)2SO4>HF>CO2>H2,
故答案为:CO2;H2;H2、CO2、HF;HF;(NH4)2SO4;SiC;SiC>(NH4)2SO4>HF>CO2>H2.
点评 本题考查了化学键、氢键和晶体,侧重考查学生分析问题、解决问题的能力,有助于调动学生的学习兴趣和学习积极性,提高学生的学习效率,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙烯与环丁烷互为同系物 | |
| B. | 碳氢化合物中的化学键都是极性键 | |
| C. | 乙醇与金属钠反应时,乙醇分子中的C-H键断裂 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| B. | 2HCO3-+2AlO2-+H2O=2CO2↑+2Al(OH)3↓ | |
| C. | NH4++AlO2-+2H2O=NH3•H2O+Al(OH)3↓ | |
| D. | 3H++Al(OH)3=Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.3NA | |
| B. | 4.48L氨气分子中含有0.6NA个N-H键 | |
| C. | 铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA | |
| D. | 4℃时,18g2H216O中含有共用电子对数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据共价键的强弱规律,推出HF的沸点强于HCl | |
| D. | 根据无机含氧酸的强弱规律,推出HNO2的酸性强于H3PO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲乙装置连接是a接c、b接d | |
| B. | 甲装置工作时H+ 移向负极 | |
| C. | 乙装置阴极室溶液的pH与电解前相比将升高 | |
| D. | a和c电极都发生CO(NH2)2-6e-+H2O═N2↑+CO2↑+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
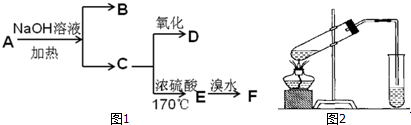
 ,反应类型氧化反应;
,反应类型氧化反应; ,反应类型加聚反应.
,反应类型加聚反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com