
【题目】轧钢厂排出的废水主要含有盐酸,通常采用的处理方法是( )
A.中和法
B.过滤法
C.氧化还原法
D.化学沉淀法
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】七铝十二钙 (12CaO·7Al2O3)是一种新型的超导材料和发光材料,它是用一定量的CaCO3溶解于酸性AlCl3溶液,再用氨水沉淀,然后煅烧沉淀制备。工业上制备七铝十二钙的流程如下图: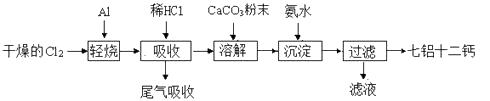
(1)轻烧后产生的AlCl3蒸气易凝华,为防止堵塞导气管可采取的措施为。
(2)吸收时用稀盐酸溶解的原因是。
(3)AlCl3溶液溶解CaCO3时,要控制碳酸钙和AlCl3的量,要求n(CaCO3)∶n(AlCl3)> 12∶14,其原因是。但若加入CaCO3过多,会产生的后果是。
(4)沉淀、过滤后的滤液主要成分是。
(5)以工业碳酸钙(含有少量Al2O3、Fe3O4杂质)生产二水合氯化钙(CaCl2·2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水, , 冰水洗涤,干燥,得到CaCl2·2H2O(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。
已知:几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算):
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.5 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为 .
(2)汽车等的安全气囊强烈碰撞时爆炸,发生的反应如后: 10NaN3+2KNO3=K2O+5Na2O+16N2↑下列判断正确的是
A.每生成8molN2转移15mol电子
B.NaN3中氮元素被还原
C.N2既是氧化剂又是还原剂
D.还原产物与氧化产物质量之比为1:15
(3)某化学兴趣小组希望能较长时间观察到白色絮状 Fe(OH)2的生成,用FeSO4(用铁粉与稀硫酸反应制得)和过量NaOH溶液反应制Fe(OH)2的装置示意图如图所示.回答下列问题: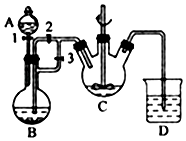
(i)A装置的名称是;在生成Fe(OH)2的装置中,发生的主要反应的离子方程式有
(ii)实验时首先打开活塞3,关闭活塞2,其目的是 .
(iii)若向制得的氢氧化亚铁的容器中通入空气,反应的化学方程式为 .
(iv)若在C中加入的是NH4HCO3时,反应时有气体产生,则最主要的离子方程式将是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A﹣I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(6)小题按题目要求回答.
族 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 氧化性最强的单质是 , 还原性最强的单质是 .
(2)最高价氧化物的水化物中碱性最强的是 , 酸性最强的是 , 呈两性的是 .
(3)A分别与D,E,F,G,H形成的化合物中,最稳定的
(4)在B,C,E,F,G,H中,原子半径最大的是
(5)A和D组成化合物的电子式
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( ) ①Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3
②S ![]() SO3
SO3 ![]() H2SO4
H2SO4
③饱和NaCl(aq) ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
④Fe2O3 ![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq) ![]() Mg(OH)2
Mg(OH)2 ![]() MgO.
MgO.
A.①③⑤
B.②③④
C.②④⑤
D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X最高价含氧酸的相对分子质量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是( )
A. X的最高价含氧酸的分子式可表示为H3XO4
B. X是第二周期第ⅤA族元素
C. X是第二周期第ⅥA族元素
D. X的最高正化合价为+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在稀硫酸中,KMnO4和H2O2能发生氧化还原反应.
氧化反应:H2O2﹣2e﹣═2H++O2↑
还原反应:MnO4﹣+5e﹣+8H+═Mn2++4H2O
(1)写出该氧化还原反应的化学方程式: .
(2)反应中氧化剂是;被氧化元素是;若有0.5mol H2O2参加此反应,电子转移个数为 .
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为;这时若有0.5mol H2O2发生分解,电子转移个数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应的通式可表示为: 单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若单质乙为植物光合作用的产物,则该反应的化学方程式为 .
(2)若单质甲和化合物B均具有磁性,则该反应的化学方程式为 .
(3)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为 .
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式 .
(5)若单质乙是黑色非金属固体单质,化合物B是一种金属氧化物,常常用作耐高温材料,则该反应的化学方程式 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com