
(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是
物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。
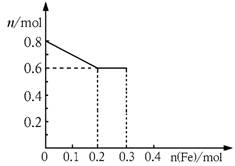
(1) 11.2g (2) 11.2<a<16.8 (3) NO3- 
【解析】(1)设Fe的物质的量是x,则生成硝酸铁也是x,所以被还原的硝酸是0.8mol-3x。根据电子的得失守恒可知,3x=3×(0.8mol-3x),解得x=0.2mol,所以铁的质量是0.2mol×56g/mol=11.2g。
(2)如果铁的氧化产物是亚铁离子,则生成硝酸亚铁是2x,所以被还原的硝酸是0.8mol-2x。根据电子的得失守恒可知,2x=3×(0.8mol-2x),解得x=0.3mol,所以铁的质量是0.3mol×56g/mol=16.8g。因此如果是反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量是11.2<a<16.8。
(3)由于最初溶液中NO3-的物质的量就是0.8mol,所以曲线表示的是NO3-的物质的量变化的曲线;根据反应的方程式Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、2Fe(NO3)3+Fe=3Fe(NO3)2可知,铁离子的最大值是0.2mol。如果继续加入铁,则开始生成亚铁离子,亚铁离子的最大值是0.3mol,因此图像为(见答案)。


科目:高中化学 来源: 题型:阅读理解
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
现 象 |
| ① | 第一份CuSO4溶液 | a | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | b | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | c | 溶液由蓝色变为深绿色 |
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
现 象 |
| ① | d | 第一份NaBr溶液 | 溶液由蓝色变为蓝绿色 |
| ② | e | 第一份NaBr溶液 | 溶液由蓝色变为草绿色 |
| ③ | f | 第一份NaBr溶液 | 溶液由蓝色变为深绿色 |
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
温度 | 现象 |
| ① | 第一份CuSO4溶液 | 第一份NaBr溶液 | 25℃ | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | 第一份NaBr溶液 | 60℃ | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | 第一份NaBr溶液 | 75℃ | 溶液由蓝色变为深绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,使木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
| ||
| ||
| 双氧水体积 | 操作情况 | 反应完成所需的时间 | 收集到气体体积 | 反应后液体温度 |
| a1%的150mL | 11分钟 | 539mL | 24℃ | |
| a2%的15mL | 混合不振荡 | 1分20秒 | 553mL | 56℃ |
| a3%的7.5mL | 9秒 | 562mL | 67℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(07年江苏卷)(10分)钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿吨,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62 g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH 溶液,充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨? (保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况)。
① 计算此钢样粉术中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末 分别加到100mL相通浓度的H2SO4溶液中,充分反 应后, 测得的实验数据如下表所示:
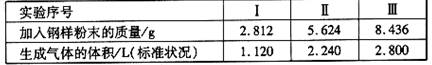 |
计算硫酸溶液的物质的量浓度。
③若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2012-2013年安徽舒城晓天中学高三上学期重点班半月考化学试卷(带解析) 题型:计算题
(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是
物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。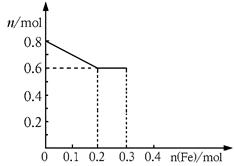
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com