
【题目】已知:
①CO(g)+1/2O2(g)== CO2(g) ΔH=-283.0kJ/mol
②C(s)+O2(g)==CO2(g) ΔH=-393.5kJ/mol
请写出 C 与 O2 反应生成 CO 气体反应的热化学方程式: _______________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.全降解塑料(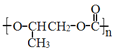 )可由环氧丙烷(
)可由环氧丙烷(![]() )和
)和![]() 在一定条件下制得
在一定条件下制得
B.在淀粉水解液中先加入过量的氢氧化钠溶液、再滴入碘水,溶液未变蓝,说明淀粉已完全水解
C.除去乙酸乙酯中的少量水分,可以用无水硫酸钠但不能用碱石灰
D.福尔马林能用于制作标本主要是使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是构成物质世界最重要的元素之一,能形成众多的化合物。
(1)已知0.096kg碳完全燃烧可放出3148kJ热量,1mol液态水汽化时要吸收44kJ热量。
①2H2(g)+O2(g)=2H2O(l) H=-571.6kJmol-1
②2CO(g)+O2(g)=2CO2(g) H=-566kJmol-1
请写出制备水煤气的热化学方程式_______________________。
(2)为研究CO2与CO之间的转化。让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H。测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示:
2CO(g) H。测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示:
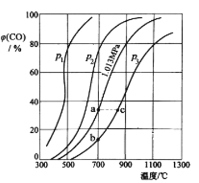
回答下列问题:
①p1、p2、p3的大小关系是__________,图中a、b、c三点对应的平衡常数大小关系是__________(用Ka、Kb、Kc表示)。
②一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K=_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”)
CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K=_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )
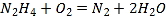
A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解质溶液为碱性溶液,阳离子向正极移动
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论一定错误的是
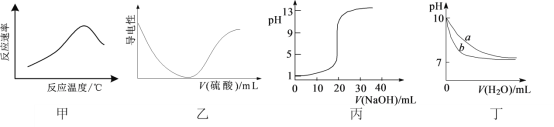
A.图甲表示酶催化反应的反应速率随反应温度的变化
B.图乙表示向BaCl2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
C.图丙表示用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸的滴定曲线
D.图丁表示相同温度下,向等体积pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )
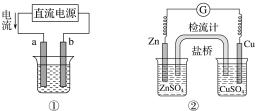
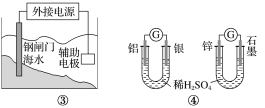
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1molL-1的(NH4)2SO4溶液,用离子方程式表示该溶液显酸性的原因:___,在该溶液中各种离子浓度由大到小的顺序为___。
(2)B为0.1molL-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:__(用离子方程式和必要的文字说明)。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入__,目的是___;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.![]() 含有的电子数为11NA
含有的电子数为11NA
B.![]() 的
的![]() 溶液中氮原子数等于0.6NA
溶液中氮原子数等于0.6NA
C.常温下,![]() 与
与![]() 混合气体中氧原子数为2NA
混合气体中氧原子数为2NA
D.硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com