
(18分)MnO2和Zn是制造干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)联合生产MnO2和Zn的工艺流程如下图所示:

(1)操作I用到硅酸盐材质的仪器有烧杯、玻璃棒和_______ _____(填仪器名称)。
(2)稀硫酸浸泡时反应的离子方程式为_______________________________________;该反应中若析出19.2g单质A,共转移____________mo1电子。浸泡时反应速率较慢,下列措施不能提高浸泡时反应速率的是________(填代号)。
a.将矿石粉碎
b.提高浸泡温度
c.适当增大硫酸浓度
d.改变软锰矿与闪锌矿的比例
(3)由硫酸锰溶液可得到固体碳酸锰,然后在空气中煅烧碳酸锰制备MnO2。已知:
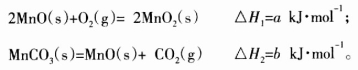
写出碳酸锰在空气中煅烧生成MnO2的热化学方程式_________________________。
(4)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示:
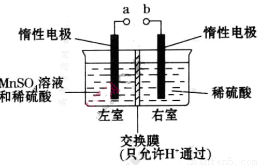
①a应与直流电源的_________(填“正”或“负”)极相连。.
②电解过程中氢离子的作用是______________和_____________;若转移的电子数为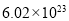 个,左室溶液中
个,左室溶液中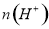 的变化量为________________。
的变化量为________________。
(1)漏斗
(2)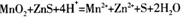 ;1.2;d
;1.2;d
(3) △H=(a+2b)kJ/mol;
△H=(a+2b)kJ/mol;
(4)①正②参与阴极反应;通过交换膜定向移动形成电流;1mol
【解析】
试题分析:(1)操作I为过滤,用到硅酸盐材质的仪器有烧杯、玻璃棒和漏斗;(2)稀硫酸浸泡时反应为MnO2和ZnS变为Mn2+和Zn2+,同时应生成S单质,故方程式为: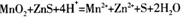 ;19.2g单质S的物质的量为0.6mol,由反应方程式可知生成1molS转移2mole-,故生成0.6molS转移1.2mole-;四个选项中,将矿石粉碎、提高浸泡温度、适当增大硫酸浓度均能提高反应速率,故答案为d;(3)由盖斯定律将反应I+II×2可得
;19.2g单质S的物质的量为0.6mol,由反应方程式可知生成1molS转移2mole-,故生成0.6molS转移1.2mole-;四个选项中,将矿石粉碎、提高浸泡温度、适当增大硫酸浓度均能提高反应速率,故答案为d;(3)由盖斯定律将反应I+II×2可得 △H=(a+2b)kJ/mol;(4)①根据装置图可知左室发生MnSO4→MnO2的反应,即发生氧化反应,故a应与直流电源的正极相连;②电解过程中阴极为H+得电子发生还原反应,又交换膜只允许H+通过,故H+的作用为参与阴极反应且通过交换膜定向移动形成电流;若转移的电子数为
△H=(a+2b)kJ/mol;(4)①根据装置图可知左室发生MnSO4→MnO2的反应,即发生氧化反应,故a应与直流电源的正极相连;②电解过程中阴极为H+得电子发生还原反应,又交换膜只允许H+通过,故H+的作用为参与阴极反应且通过交换膜定向移动形成电流;若转移的电子数为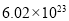 个即1mol,根据电荷守恒氢离子物质的量变化为1mol。
个即1mol,根据电荷守恒氢离子物质的量变化为1mol。
考点:考查化学实验基本操作、离子方程式的书写、氧化还原反应、化学反应速率影响因素、盖斯定律、电化学等知识。


科目:高中化学 来源:2013-2014山东省6月月考高一化学必修2试卷(解析版) 题型:选择题
下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高一化学试卷(解析版) 题型:选择题
下列关于化学反应速率的说法中正确的是( )
A.决定化学反应速率的主要因素是温度
B.反应速率用于衡量化学反应进行快慢
C.可逆反应达到平衡状态时正逆反应的速率都为0
D.增大反应物的量或提高反应温度一定能增大反应速率
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省乳山市下学期期中考试高一化学试卷(解析版) 题型:选择题
短周期的金属元素,在化学性质上必然是
A.单质都能跟Cl2反应生成氯化物 B.氧化物都是碱性氧化物
C.化合态时只能以简单阳离子形式存在 D.单质都不与强碱溶液反应
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省乳山市下学期期中考试高一化学试卷(解析版) 题型:选择题
决定化学反应速率的主要因素是
A.参加反应的物质本身的性质 B.催化剂
C.温度、压强以及反应物的接触面 D.反应物的浓度
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三三模试卷理科综合化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.FeCl3溶液中加入镁粉有气泡产生
B.C12、SO2均能使品红溶液褪色,说明二者均有漂白性
C.铅蓄电池在放电过程中,负极质量减小,正极质量增加
D.向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:填空题
(18分)NOx、SO2是主要的大气污染物,科学处理这些污染物对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H= kJ?mol-1。
(2)利用氧化氮氧化物的流程如下:
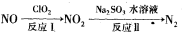
写出反应Ⅱ的化学方程式 ___________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移0.5mol电子,则反应Ⅱ中可生成N2的体积
为_________L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_________移动(填“向左”、“向右”或“不”);试计算溶液中  。
。
(常温下H2SO3的电离常数: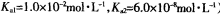 )
)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。
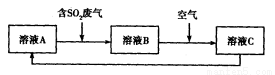
①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②假设反应过程中溶液的体积不变,A、C两溶液的pH大小关系为:pH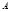 ___pH
___pH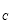 。(填
。(填
“>”、“=”或“<”)。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论_____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省下学期高二期末化学模拟试卷(解析版) 题型:选择题
某一溴代烷水解后的产物在红热铜丝催化下,最多可被空气氧化生成4种不同的醛,该一溴代烷的分子式可能是
A.C4H9Br B.C5H11Br C.C6H13Br D.C7H15Br
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第三次教学质量检查理综化学试卷(解析版) 题型:选择题
化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,下列关于描述正确的是
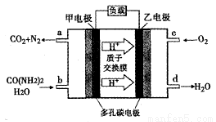
A、电池工作时H+ 移向负极
B、该电池用的电解质溶液是KOH溶液
C、甲电极反应式为:CO(NH2 )2 + H2O - 6e-= CO2 + N 2 + 6H+
D、电池工作时,理论每有净化1mol CO(NH2 )2 ,消耗 33.6 L O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com