
分析 (1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,Na2O2用于制呼吸面具;
(2)氯化铵固体和熟石灰混合加热生成氨气、水和氯化钙,可用于实验室制取氨气;
(3)氢氟酸能够与二氧化硅反应生成四氟化硅气体和水,可用于刻蚀玻璃;
(4)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,用氯气和石灰乳反应制备漂白粉.
解答 解:(1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为2Na2O2+2CO2=2Na2CO3+O2,可将人体呼出的二氧化碳转化为氧气,所以可用过氧化钠制呼吸面具,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;Na2O2制呼吸面具;
(2)铵盐和碱反应生成氨气,氯化铵固体和熟石灰混合加热生成氨气、水和氯化钙,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,该反应可用于实验室制取少量氨气,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;实验室制取氨气;
(3)玻璃中含有SiO2,可以用HF(氢氟酸)来刻蚀玻,反应的化学方程式为SiO2+4HF=SiF4↑+2H2O,
故答案为:SiO2+4HF═SiF4↑+2H2O;雕刻玻璃;
(4)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,该反应为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,用氯气和石灰乳反应制备漂白粉,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;制取漂白粉.
点评 本题考查元素化合物知识,侧重于基础知识的考查,为高频考点,注意把握常见物质的性质以及反应的化学方程式的书写,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH2CH2Cl | B. | (CH3)3CCH2OH | C. | CH3CHClCHO | D. | CH2=CHCH2COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
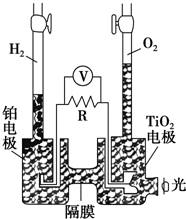 TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将光能转化为电能,同时也能将其转化为化学能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
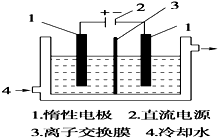 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸酐一定是氧化物 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 碱性氧化物一定是金属氧化物 | |
| D. | 正四面体分子中键角一定是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -10+3n | B. | -6+3n | C. | -(12-3n) | D. | -(4-2n) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| B. | 1L0.1 mol/L的NH4NO3溶液中氮原子数小于0.2NA | |
| C. | 某温度时,1LpH=6的纯水中含有1.0X10-6NA个OH- | |
| D. | 含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com