
| A. | 用纯锌和稀硫酸反应 | B. | 用含铜等的粗锌和稀硫酸反应 | ||
| C. | 用纯锌和浓硫酸反应 | D. | 用含铜等的粗锌和稀硝酸反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
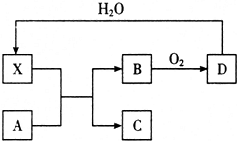 已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( )| A. | X能使蔗糖变黑主要体现了 X的强氧化性 | |
| B. | 若A为铁,则足量A与X在室温下即可完全反应 | |
| C. | 若A为碳单质,则将C通入少量澄清石灰水中,最终一定有白色沉淀产生 | |
| D. | 工业上,B转化为D的反应需使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 治疗胃酸过多,可用NaHCO3,不能用Al(OH)3,因其含有Al元素 | |
| B. | Al箔用砂纸打磨后,在空气中受热可以熔化,由于氧化膜被破坏,熔化的Al可以滴落 | |
| C. | 用铂丝做焰色反应实验,每次做完后都需要用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用 | |
| D. | 实验室制备Al(OH)3时,氨水不宜过量,因为Al(OH)3与过量的浓氨水反应生成NH4AlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 4.2g | C. | 8.4g | D. | 11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol固态焦炭与1mol水蒸气反应产生1mol一氧化碳和1mol氢气,吸收131.3 kJ的热量 | |
| B. | 碳与水反应吸收131.3 kJ的热量 | |
| C. | 1mol碳和1mol水反应吸收131.3 kJ的热量 | |
| D. | 固态碳和气态水各1mol反应,放出131.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com