
分析 (1)硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,再结合电荷守恒判断离子浓度大小;
(2)碳酸氢钠溶液中存在碳酸氢根离子的水解、电离平衡;
(3)亚铁离子和铵根水解均显酸性,亚铁离子水解抑制铵根的水解,(NH4)2Fe(SO4)2溶液中c(NH4+)稍大,以此解答该题;
(4)含有银离子或氯离子的溶液抑制AgCl溶解,氯离子或银离子浓度越大其抑制AgCl溶解程度越大.
解答 解:(1)硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c (NH4+)>c(SO42-),铵根离子水解程度较小,则溶液中离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(2)碳酸氢钠溶液中存在碳酸氢根离子的水解、电离平衡,其离子方程式分别为:HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-,
故答案为:HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-;
(3)(NH4)2Fe(SO4)2中NH4+和Fe2+都水解呈酸性,水解相互抑制,因此(NH4)2Fe(SO4)2中NH4+的水解程度(NH4)2SO4的要小,(NH4)2Fe(SO4)2比(NH4)2SO4的c(NH4+)大.
故答案为:(NH4)2Fe(SO4)2;NH4+和Fe2+都水解呈酸性,水解相互抑制;
(4)含有银离子或氯离子的溶液抑制AgCl溶解,氯离子或银离子浓度越大其抑制AgCl溶解程度越大,氯化镁和硝酸银溶液抑制AgCl溶解,但硝酸银是可溶性盐,所以硝酸银溶液中银离子浓度最大,则Ag+浓度由大到小的顺序为②①③,c(Cl-)=$\frac{1.8×1{0}^{-10}}{0.3}$mol/L=6×10-10 mol/L,
故答案为:②①③;6×10-10 mol/L.
点评 本题考查了离子浓度大小比较、难溶物的溶解平衡等知识点,根据溶质的性质结合电荷守恒判断离子浓度大小,根据溶度积常数计算氯离子浓度,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 将2-氯丙烷与NaOH的醇溶液共热制备CH3-CH═CH2 | |
| B. |  与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 | |
| C. | 用分液法分离苯和液溴的混合物 | |
| D. | 向卤代烃水解后的溶液中直接加入硝酸银溶液,可以确定卤代烃中的卤元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如图:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如图:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol HI | 1mol H2+1mol I2 | 2mol HI+1mol H2+1mol I2 |
| HI的浓度 | c1 | c2 | c3 |
| 反应的能量变化 | 吸收akJ | 放出bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在4mL0.1mol/L的K2Cr2O7溶液中滴加数滴1mol/LNaOH溶液,溶液颜色从橙色变成黄色 | |
| B. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| C. | 在试管中加入少量氯化钴晶体,滴加浓盐酸溶解后加水稀释至紫色,将试管置于热水中片刻,溶液颜色变成粉红色 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),从针筒顶端观察,气体颜色逐渐变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000mL水中所含K+、SO42-总数为0.15NA | |
| B. | 500mL溶液中含有0.1NA个K+ | |
| C. | 1L溶液中K+的浓度为0.1mol/L | |
| D. | 1L溶液中SO42-的浓度是0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75.77%表示35Cl的质量分数 | |
| B. | 35.5表示氯元素的近似相对原子质量 | |
| C. | 24.23%表示35Cl的丰度 | |
| D. | 36.966表示37Cl的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
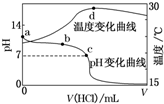 室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14 mol•L-1 | |
| B. | b点:c(NH${\;}_{4}^{+}$)+c(NH3•H2O)=c(Cl-) | |
| C. | c点:c(Cl-)=c(NH${\;}_{4}^{+}$) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com