
| 编号 | ① | ② | ③ |
| X的化学式 | NaOH | Na2O2 | |
| 加入X的质量(g) | 6.2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1.6g |
| 16g/mol |
| 编号 | ① | ② | ③ |
| X的化学式 | NaOH | Na2O2 | Na2O |
| 加入X的质量(g) | 8 | 7.8 | 6.2 |


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
 合成
合成 (部分试剂和反应条件已去).请回答下列问题:
(部分试剂和反应条件已去).请回答下列问题: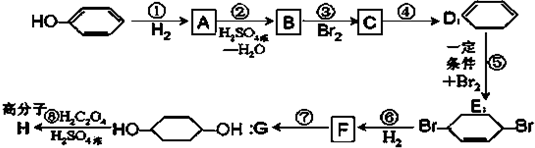
 ,写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学方程式:
,写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学方程式: 的化学方程式(有机物写结构简式,注明反应条件).
的化学方程式(有机物写结构简式,注明反应条件). ,其PMR谱中有2个信号峰,其强度之比为3:1.则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是
,其PMR谱中有2个信号峰,其强度之比为3:1.则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是 B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、其它条件不变,加入催化剂,△H变大 |
| B、及时除去二氧化碳,正反应速率加快 |
| C、降低温度,可提高反应物的转化率 |
| D、若气体的密度保持不变,说明平衡不发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向次氯酸钙溶液通入少量CO2:2ClO-+H2O+CO2=CO32-+2HClO |
| B、向明矾溶液中加入足量Ba(OH)2溶液:Al3++2SO42-+4OH-+2Ba2+=2BaSO4↓+[Al(OH)4]- |
| C、向FeCl3溶液中加入足量单质锌:Zn+2Fe3+=Zn2++2Fe2+ |
| D、向NaHSO4中滴加Ba(OH)2溶液至中性:H++SO42-+OH-+Ba2+=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠熔化成银白色小球 |
| B、在液面快速游动 |
| C、溶液底部出现光亮的银白色固体 |
| D、溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
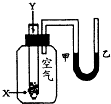 某学生用如右图所示的装置进行化学反应X+2Y→2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到试管中甲处液面下降,乙处液面上升.关于该反应的下列叙述正确的是( )
某学生用如右图所示的装置进行化学反应X+2Y→2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到试管中甲处液面下降,乙处液面上升.关于该反应的下列叙述正确的是( )| A、①②③ | B、①③ | C、②③ | D、③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com