
 LiOH和钴氧化物可用于制备锂离子电池正极材料.利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法不正确的是( )
LiOH和钴氧化物可用于制备锂离子电池正极材料.利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法不正确的是( )| A. | B极区电解液为LiOH溶液 | |
| B. | 每产生标准状况下2.24L氢气,就有0.1 mol阳离子通过交换膜进入阴极区 | |
| C. | 电解过程中Li+向B电极迁移 | |
| D. | 阳极电极反应式为2Cl--2e-=Cl2↑ |
分析 根据图知,B电极上有氢气生成,则B为电解池阴极,阴极电极反应式为2H2O+2e-=2OH-+H2↑,A为阳极,阳极反应式为2Cl--2e-=Cl2↑,结合电荷守恒计算.
解答 解:A.根据以上分析知,B为电解池阴极,阴极电极反应式为2H2O+2e-=2OH-+H2↑,所以B极区电解液为LiOH溶液,故A正确;
B.每产生标准状况下2.24L氢气,所以有0.2mol电子转移,根据电荷守恒知,就有0.2mol阳离子通过交换膜进入阴极区,故B错误;
C.电解过程中Li+向阴极B电极迁移,故C正确;
D.A为阳极,电极上氯离子放电,电极反应式为2Cl--2e-=Cl2↑,故D正确;
故选B.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应、各个区域电解质溶液成分是解本题关键,会正确书写电极反应式,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 醋酸加入到碳酸钠固体中,将产生的气体通入C6H5ONa 溶液中 | 溶液变浑浊 | 酸性:CH3COOH>H2CO3>C6H5OH |
| B | CH3CH2Br 与NaOH 乙醇溶液共热产生的气体通入溴水中 | 溶液褪色 | 产生了乙烯 |
| C | 向某氯化亚铁溶液中加入加入Na2O2 粉末 | 出现红褐色沉淀 | 加入 Na2O2 粉末前,原氯化亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
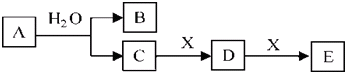
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| W | 周期表中原子半径最小的元素 |
| X | 氢化物可与其最高价氧化物的水化物反应生成盐 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | M层比K层少1个电子 |
| T | 存在两种同素异形体,其中一种可吸收紫外线 |
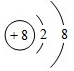 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
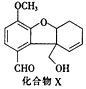
| A. | 分子中含2个手性碳原子 | |
| B. | 分子中所有碳原子均处于同一平面 | |
| C. | 能发生银镜反应,不能发生酯化反应 | |
| D. | 1molX最多能与4molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
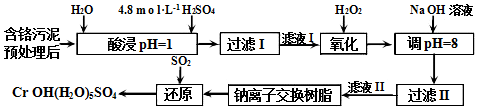
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:苯酚(
已知:苯酚(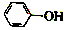 )在水中的电离方程式为
)在水中的电离方程式为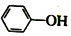 ?
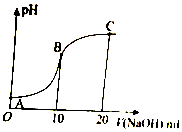
?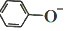 +H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )
+H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )| A. | A点溶液中,苯酚的电离度约为0.01% | |
| B. | B点溶液的pH<7 | |
| C. | C点溶液中存在c(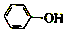 )>c(OH-)>c(H+) )>c(OH-)>c(H+) | |
| D. | A 点溶液加少量水稀释,溶液中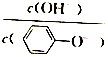 减小 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.7gNH4C1中含有的共用电子对数为NA | |
| B. | 0.5mol•L-1CH3COONa溶液中含有CH3COO-的数目少于0.5 NA | |
| C. | 22gN2O和22gCO2所含有的质子数均为11NA | |
| D. | 足量的镁与一定量的浓硫酸充分反应,放出2.24LSO2和H2混合气体时,转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com