
【题目】按要求回答下列问题:
(1)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是__________。
A 溶液中导电粒子的数目减少 B 醋酸的电离程度增大,c(H+)亦增大
C 溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]不变 D 溶液中c(CH3COO-)/c(H+)减小
(2)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=_____________(溶液体积变化忽略不计)。
(3)常温下,浓度均为0.lmol/L的下列五种溶液的pH值如表所示:
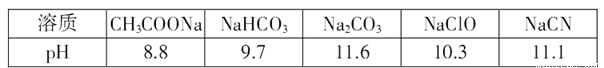
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是_____
A HCN B HClO C H2CO3 D CH3COOH
②根据以上数据,判断下列反应可以成立的是________。
A CH3COOH+Na2CO3=NaHCO3+CH3COONa B CH3COOH+NaCN=HCN+CH3COONa
C CO2 +H2O+ 2NaClO=Na2CO3+2HClO D NaHCO3+HCN=NaCN+CO2 +H2O
(4)几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度离子Cu2+、Fe2+、Mg2+的溶液中滴加NaOH溶液时,_________(填离子符号)先沉淀。
(5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是__________;
②体积相同、c(H+
【答案】CD 1:1 A AB Cu2+ Na2CO3溶液 b>a>c
【解析】
(1)醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,醋酸电离产生的醋酸根离子和氢离子数目增多浓度减小,根据醋酸的电离程度确定溶液中微粒个数变化.
(2)①所得溶液的pH值为1,溶液中氢离子浓度为1×10-1molL-1,说明氢离子过量,根据题中稀硫酸和氢氧化钠溶液体积列式计算出V1:V2的比值;
(3)①相同浓度的钠盐溶液,酸的酸性越弱,则酸根离子水解程度越大;
②根据强酸制取弱酸判断;
(4)根据表格可知:Cu2+开始沉淀的pH最小,所以Cu2+先沉淀;
(5)根据电离常数确定酸性强弱:HCOOH>H2CO3>HCN>HCO3-。
①酸性越弱,对应盐的水解能力越强,碱性越强,
②体积相同、c(H+)相同的三种酸溶液,酸性越弱的物质的量浓度越大,消耗NaOH越多。
(1)A.醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,醋酸电离产生的醋酸根离子和氢离子数目增多,故A错误;
B.加水稀释,促进电离,但离子浓度降低,故B错误;
C.c(CH3COO-)/[c(CH3COOH)c(OH-)]=Ka/Kw,电离平衡常数和水的离子积常数不变,所以其不变,故C正确;
D.无限稀释相当于水,但体积增加,醋酸根离子浓度减小,氢离子浓度基本不变,所以c(CH3COO-)/c(H+)比值减小,故D正确;
答案:CD
(2)①溶液中氢氧化钠的物质的量为:V2×10-3L×0.1mol/L=V2×10-4mol,稀硫酸中氢离子的物质的量为:V1×10-3L×0.15mol/L×2=3V1×10-4mol,两溶液混合后溶液显示酸性,氢离子浓度为1×10-1molL-1,则有:3V1×10-4mol-V2×10-4mol=(V1+V2)×10-3L×1×10-1molL-1=(V1+V2)×10-4mol,解得V1:V2=1:1;
答案:1:1
(3)①相同浓度的钠盐溶液,酸的酸性越弱,则酸根离子水解程度越大,根据钠盐溶液pH确定酸的强弱,CH3COOH>H2CO3>HClO>HCN>HCO3-;相同浓度的不同酸,加水稀释促进弱酸电离,则稀释相同的倍数,酸的酸性越弱,酸溶液稀释过程中pH变化越小,所以溶液的pH变化最小的是HCN,故选A;
答案:A
②酸性CH3COOH>H2CO3>HClO>HCN>HCO3-,根据强酸制取弱酸知:
A.酸性CH3COOH>H2CO3>HCO3-,所以二者反应为CH3COOH+Na2CO3═NaHCO3+CH3COONa,故A正确;
B.醋酸酸性大于HCN,所以二者反应为CH3COOH+NaCN═CH3COONa+HCN,故B正确;
C.酸性H2CO3>HClO>HCO3-,所以二者反应为CO2+H2O+NaClO═NaHCO3+NaClO,故C错误;
D.酸性HCN>HCO3-,所以NaHCO3、HCN二者不反应,故D错误;
答案:AB
(4)根据表格可知:Cu2+开始沉淀的pH最小,所以Cu2+先沉淀;
答案:Cu2+
(5)根据电离常数确定酸性强弱:HCOOH>H2CO3>HCN>HCO3-。
①酸性越弱,对应盐的水解能力越强,碱性越强,因此同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是Na2CO3;
答案:Na2CO3溶液
②体积相同、c(H+)相同的三种酸溶液,酸性越弱的物质的量浓度越大,消耗NaOH越多;因此a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是b>a>c。
答案:b>a>c


科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示:
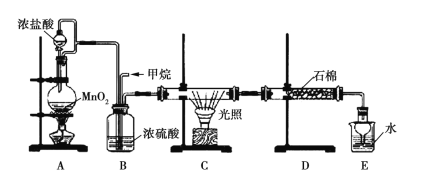
(1)A中制取Cl2的反应的化学方程式是_________________________。
(2)B装置的作用:①______;②______;③______。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是________________。
(4)E装置的作用是_____(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(6)将1 mol CH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产钠和烧碱的原理如下:①电解熔融氯化钠制钠:2NaCl(熔融) ![]() 2Na+Cl2↑,②电解饱和食盐水制烧碱:2NaCl+2H2O
2Na+Cl2↑,②电解饱和食盐水制烧碱:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,下列有关说法正确的是( )
2NaOH+H2↑+Cl2↑,下列有关说法正确的是( )
A.在反应①和②中,氯化钠均既是氧化剂,又是还原剂
B.在反应①中氯气是还原产物,在反应②中氢气是还原产物
C.若标准状况下生成等体积的气体,则反应①和②中转移电子总数相等
D.若消耗等质量的氯化钠,则反应①和②中转移电子总数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是( )
A. NaOH溶液滴入FeSO4溶液中,产生白色沉淀,随后变为红褐色
B. 石蕊溶液滴入氯水中,溶液变红,随后迅速褪色
C. Na2S溶液滴入AgCl浊液中,沉淀由白色逐渐变为黑色
D. 热铜丝插入稀硝酸中,产生无色气体,随后变为红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过如下流程制备氧化亚铜:
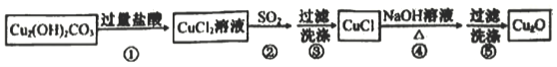
已知CuCl难溶于水和稀硫酸:Cu2O+2H+==Cu2++Cu+H2O
下列说法不正确的是
A. 步骤②SO2可用Na2SO3替换
B. 步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C. 步骤④发生反应的离子方程式为2CuCl+2OH-=Cu2O+2Cl-+H2O
D. 如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,根据反应前、后固体质量可计算试样纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,常用于制作重要的电子元件材料和蓄电池材料。某实验室尝试用工业废弃的NiO催化剂(还含有Fe2O3、CaO、CuO、BaO等杂质)为原料生产2NiOOHH2O沉淀,继而制备Ni2O3。实验工艺流程为:
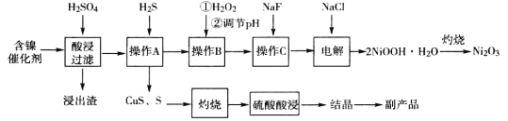
已知:①有关氢氧化物开始沉淀和沉淀完全的pH如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.6 | 9.7 | 9.2 |
②常温下CaF2难溶于水,微溶于无机酸
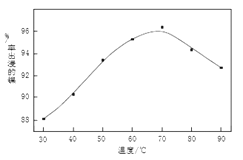
(1)操作B中需调节pH范围为____,使用Na2CO3调节pH过程中发生的反应有___。实验人员发现温度不同时,镍的浸出率不同,浸出率与温度的关系如图所示。请解释当温度高于70℃时,浸出液中Ni2+含量降低的原因____。
(2)下列说法正确的是____
A.为提高酸浸效率,可充分搅拌或适当提高硫酸浓度
B.操作A中应持续通入过量H2S气体使杂质Cu2+彻底沉淀
C.浸出渣的主要成分为CaSO42H2O和BaSO4
D.为得到副产品胆矾,应蒸发浓缩至出现大量晶体,用玻璃纤维代替滤纸进行趁热过滤
(3)电解过程中,Cl-在阳极被氧化为ClO-,但是反应前后溶液中Cl-浓度不变。写出生成沉淀反应的离子方程式_____。
(4)操作C加入NaF后如何证明沉淀完全____。
(5)工业上也可通过将草酸镍(NiC2O42H2O)在热空气中干燥脱水,再在高温下煅烧三小时制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙丙三种物质间通过一步反应能实现如图转化,下列选项中符合转化关系的是( )
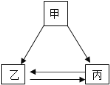
A.甲为NaOH,乙为NaCl,丙为NaNO3
B.甲为CuO,乙为CuCl2,丙为Cu(OH)2
C.甲为Na2CO3,乙为CO2,丙为CaCO3
D.甲为H2SO4,乙为BaSO4,丙为Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com