
| A. | 硫离子的结构示意图: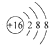 | |
| B. | 原子核内有10个中子的氧离子:${\;}_{8}^{18}$O | |
| C. | NH4Cl的电子式: | |
| D. | 乙烯的结构简式C2H4 |
分析 A.硫离子的质子数是16,核外电子数为18;
B.氧离子带2个单位负电荷,质量数=质子数+中子数;
C.氯化铵是离子化合物,由氨根离子与氯离子构成,氯离子符号表示错误;
D.乙烯中含有碳碳双键,结构简式中碳碳双键不能省略.
解答 解:A.硫原子的质子数是16,核外电子数为18,原子结构示意图为 ,故A正确;
,故A正确;
B.原子核内有10个中子的氧离子,质量数=10+8=18,带2个单位负电荷,离子符号为818O2-,故B错误;
C.氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为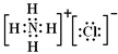 ,故C错误;
,故C错误;
D.乙烯分子中含有碳碳双键,为官能团,乙烯的结构简式为CH2=CH2,故D错误;
故选:A.
点评 本题考查了常见化学用语的书写,涉及原子结构示意图、电子式、离子符号、有机物结构简式的书写,明确相关化学用语的书写方法即可解题,题目难度不大.


科目:高中化学 来源: 题型:解答题
 (1)1mol乙烷在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3kJ,写出乙烷燃烧的热化学方程式C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1558.3KJ/mol;
(1)1mol乙烷在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3kJ,写出乙烷燃烧的热化学方程式C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1558.3KJ/mol;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以CH4和H2O为原料,通过下列反应来制备甲醇.
以CH4和H2O为原料,通过下列反应来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 反应①中的能量变化如图所示: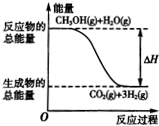 | |
| C. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ/mol | |
| D. | CH3OH转变成H2的过程一定要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
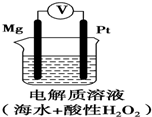 某潜航器使用新型镁-过氧化氢燃料电池系统,其工作原理如图所示.以下说法中错误的是( )
某潜航器使用新型镁-过氧化氢燃料电池系统,其工作原理如图所示.以下说法中错误的是( )| A. | 当电路中有2 mol电子转移时,镁电极的质量减轻24 g | |
| B. | 电池工作时,正极上有H2生成 | |
| C. | 工作过程中溶液的pH会增大 | |
| D. | 电池正极的反应式为H2O2+2e-+2H+═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于置换反应 | |
| B. | 属于氧化还原反应 | |
| C. | 属于离子反应 | |
| D. | 1molFe参加反应失去的电子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com