
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示。
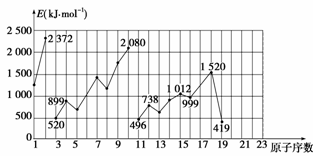
试根据元素在同期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是_________________________________。各主
族中E值的这种变化特点体现了元素性质的____________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系式中正确的是________(填写编号,多选倒扣)。
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:
_____<E<____________。
(4)10号元素E值较大的原因是____________________。
(1)随着原子序数增大,E值变小 周期性
(2)①③ (3)419 738 (4)10号元素为氖,该元素原子的最外层电子排布已达到8电子稳定结构
解析 此题考查了元素第一电离能的变化规律和学生们的归纳总结能力。
(1)从H、Li、Na、K等可以看出,同主族元素随元素原子序数的增大,E值变小;H到He、Li到Ne、Na到Ar呈现明显的周期性。
(2)从第2、3周期可以看出,ⅢA和ⅥA族元素比同周期相邻两种元素E值都低。由此可以推测E(砷)>E(硒)、E(溴)>E(硒)。
(3)根据同主族、同周期规律可以推测:E(K)<E(Ca)<E(Mg)。
(4)10号元素是稀有气体元素氖,该元素原子的最外层电子排布已达到8电子稳定结构。


科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.在饱和氯水中Cl-、NO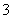 、Na+、SO
、Na+、SO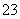 可以大量共存
可以大量共存
B.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
C.向无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色说明原溶液中有I-
D.SO2通入碘水中,反应的离子方程式为SO2+I2+H2O===SO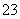 +2I-+2H+
+2I-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
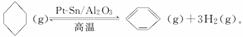 在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.同族元素,随着电子层数的增加,I1逐渐增大
B.同周期元素,随着核电荷数的增加,I1逐渐增大
C.通常情况下,电离能I1<I2<I3
D.电离能越小,元素的金属性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是( )
A.K、Na、Li B.Al、Mg、Na
C.N、O、C D.Cl、S、P
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,按熔点由低到高排列的是( )
A.O2、I2、Hg B.CO2、Al2O3、KCl
C.Na、K、Rb D.H2S、H2Se、H2Te
查看答案和解析>>
科目:高中化学 来源: 题型:
铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与5.6 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为( )
A.16 g B.32 g
C.64 g D.无法计算
★ ★★
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com