
| 醇 |
| 醇 |
| 醇 |
| 醇 |
| 醇 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
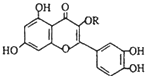 天然维生素P(结构如图,其中烃基R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
天然维生素P(结构如图,其中烃基R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A、可以使酸性KMnO4溶液褪色 |
| B、分子中有三个苯环 |
| C、1mol维生素P可以和4mol NaOH反应 |
| D、维生素P与溴水反应时1mol维生素P可以消耗6mol Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 80 | 100 | 120 |
| K | 1.80 | 2.76 | 3.45 |
| 时间(s) N(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 2.80 | a | 2.00 | c | d | 1.60 |
| n(NO2) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
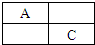 A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素.
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)-c(X-)=9.9×10-7mol/L |
| B、c(Na+)=c(X-)+c(HX)=0.1mol/L |
| C、c(OH-)-c(HX)=c(H+)=1×10-6mol/L |
| D、混合溶液中由水电离出的c(OH-)小于0.2mol/LHX溶液中由水电离出的c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com