
【题目】若使下列物质水溶液的浓度增大,可选用加热蒸发的是
A. 浓盐酸B. 稀硫酸
C. 饱和食盐水D. 饱和硫酸铜溶液
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】溴苯可用作有机溶剂溴苯是制备精细化工品的原料,也是制备农药的基本原料。其制备可采用下列装置:

有关数据如下表:
密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 | |
溴 | 3.12 | -7.2 | 58.8 | 微溶于水,易溶于乙醇、乙醚、氯仿、四氯化碳等 |
苯 | 0.88 | 5.5 | 80.1 | 不溶于水,易溶于有机溶剂 |
溴苯 | 1.50 | -30.7 | 156.2 | 不溶于水,溶于甲醇、乙醚、苯、四氯化碳等多数有机溶剂 |
有关反应:
(ⅰ)![]() +Br2
+Br2![]()
![]() +HBr(溴苯制备反应)
+HBr(溴苯制备反应)
(ⅱ)![]() +H2O
+H2O![]() +HBr(反应微弱)
+HBr(反应微弱)
实验步骤:
在装置A底部放入少许石棉丝,然后加入2g铁粉;装置C中加入由22.0mL苯和10.0mL液溴混合而成的混合液;其他装置的试剂如图所示;打开装置 C的活塞,使苯、液溴混合液滴到铁粉上;取下装置B,进行下列流程图中的操作,最后得到11.1 mL溴苯。
粗溴苯与
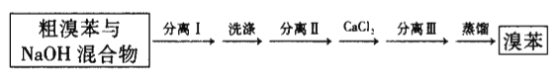
回答下列问题:
(1)装置A中的铁粉可以用___________(填试剂的化学式)代替,原因是___________。
(2)装置B中的NaOH的作用是_____________________。
(3)装置D中苯的作用是___________。
(4)分离Ⅰ、分离Ⅱ、分离Ⅲ分别为___________(填标号)。
a.分液、蒸馏、过滤 b.分液、分液、过滤
c.过滤、分液、过滤 d.分液、过滤、过滤
(5)流程图中加入的CaCl2的作用是___________,若实验过程中省略该步操作,实验的产率_________(填“偏高”偏低“或“不变”)。
(6)本实验的产率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池是一种常见化学电源,其反应原理为Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的是 ( )
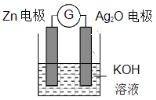
A. 放电过程中,负极质量会增加
B. Ag2O 电极发生还原反应
C. Zn 电极的电极反应式:Zn-2eˉ+2OHˉ=Zn(OH)2
D. 放电前后电解质溶液的碱性保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在水溶液中能大量共存的是( )
A.Na+、Cl﹣、HCO3﹣、Ca2+
B.OH﹣、Na+、Mg2+、HCO3﹣
C.Na+、Cl﹣、H+、Ag+
D.Na+、SiO32﹣、H+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一碳化学是指以分子中只含一个碳原子的化合物(如一氧化碳、二氧化碳、甲烷、甲醇等)为原料,用化工的方法制造产品的化学体系的总称。我国能源比较丰富,煤的探明储量6000亿吨,居世界第三位,因此,发展一碳化学有着优越的条件和光明的前途。请回答下列有关问题。
(1)已知在一定温度下有如下反应:
I.C(s)+CO2(g)![]() 2CO(g)H1=akJ/mol
2CO(g)H1=akJ/mol
II.CO(g)+H2O(g)![]() H2(g)+CO2(g)△H2=bkJ/mol
H2(g)+CO2(g)△H2=bkJ/mol
III.C(s)+H2O(g)![]() CO(g)+H2(g)△H3________。
CO(g)+H2(g)△H3________。
(2)在一恒容的密闭容器中,加入lmolCO(g)、2molH2O(g),发生反应CO(g)+H2O(g)![]() H2(g)+CO2(g) △H ,CO的平衡转化率随温度的变化如图所示:
H2(g)+CO2(g) △H ,CO的平衡转化率随温度的变化如图所示:
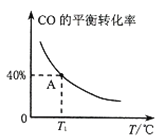
①该反应的△H__0(填“<”或“>”。)
②在某温度下,能判断该反应是否达到化学平衡状态的依据是________。
a.混合气体中c(CO)不变 b.c(CO)=c(CO2)
c.υ正(H2O)=υ逆(H2) d.混合气体的平均相对分子质量不变
③A点时H2O(g)的转化率为__________。
④在体积不变时,要增大该反应的正反应速率可采取的措施是_______(写两条)。
⑤A点时该反应的平衡常数为________(保留到小数点后两位)。
⑥若在该容器中充入2molCO和3mol水蒸气进行反应,达到平衡时水蒸气的体积分数与H2的体积分数相等,则平衡后CO的体积分数为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com