
| 研碎后加入试剂1 |
| 静置 |
| KSCN溶液 |
| 新制氯水 |
| Vc |

| 1000mL |
| 20mL |
| 3.36g |
| 10g |


科目:高中化学 来源: 题型:
| A、1L 0.1 mol?L-1 NaCl溶液中含0.1NA个Na+ |
| B、22.4L NH3含4NA个原子 |
| C、标准状况下,22.4L H2O中含有10NA个电子 |
| D、NA个SO2分子的质量为64 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
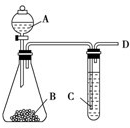 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:
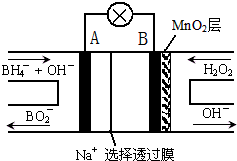
| A、电极B为正极 |
| B、放电过程中,Na+从正极区向负极区迁移 |
| C、电池负极的电极反应为:BH4-+8OH--8e-═BO2-+6H2O |
| D、在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
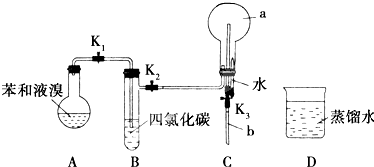
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com