
 .
.分析 元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.Y元素原子最外层电子数与核外电子总数之比为3:4,最外层电子数只能为6,则原子总数为8,Y为O元素;M原子最外层电子数与次外层电子数之比为3:4,原子有3个电子层,最外层电子数为6,则M为S元素;结合N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,可判N为Cl元素,Z为Na元素,X为氢元素;元素Q价电子为3d104s1,则Q为Cu.
(1)硫的两种含氧酸有亚硫酸、硫酸,中心元素化合价越高,对电子对的吸引越大,更有利于电离出氢离子;
(2)Z与M可形成常见固体化合物C为Na2S,由钠离子与硫离子构成;
(3)计算1molH2燃烧放出的热量,注明物质的聚集状态与反应热书写热化学方程式,且H2的化学计量为1;
(4)X与Y形成的18电子分子为H2O2、X与M形成的18电子分子为H2S,这两种分子在水溶液中反应有黄色沉淀生成,即反应生成S与水;
(5)H3O+离子中O原子孤电子对=$\frac{6-1-1×3}{2}$=1,价层电子对数=3+1=4;
化合物A为Cu元素的二价离子与H2O分子构成的配位数为4的络合物,该配离子为[Cu(H2O)4]2+,A的水溶液呈现天蓝色,逐滴加入氨水,形成蓝色沉淀为Cu(OH)2,后蓝色沉淀溶解生成[Cu(NH3)4]2+;
(6)均由X、Y、Z、M四种元素组成的两种盐为NaHSO3、NaHSO4,二者反应生成硫酸钠、二氧化硫与水;
(7)已知Q是面心立方晶体,以顶点Q原子研究,与之相邻的Q原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用;
若Q原子的半径为r,则晶胞棱长为4r×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r,计算晶胞体积,利用均摊法计算晶胞中Q原子数目,计算晶胞中Q原子占有的总体积,晶胞中原子的空间利用率=$\frac{原子总体积}{晶胞体积}$×100%.
解答 解:元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.Y元素原子最外层电子数与核外电子总数之比为3:4,最外层电子数只能为6,则原子总数为8,Y为O元素;M原子最外层电子数与次外层电子数之比为3:4,原子有3个电子层,最外层电子数为6,则M为S元素;结合N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,可判N为Cl元素,Z为Na元素,X为氢元素;元素Q价电子为3d104s1,则Q为Cu.
(1)S的两种含氧酸可写成(HO)2SO、(HO)2SO2,硫酸中S的正电性比亚硫酸中高,导致S-O-H中O的电子向S偏移,因而在水分子的作用下也就越容易电离出H+,酸性越强,硫酸的酸性更强,
故答案为:H2SO4;S的两种含氧酸可写成(HO)2SO、(HO)2SO2,硫酸中S的正电性比亚硫酸中高,导致S-O-H中O的电子向S偏移,因而在水分子的作用下也就越容易电离出H+,酸性越强;
(2)Z与M可形成常见固体化合物C为Na2S,由钠离子与硫离子构成,用电子式表示形成过程为 ,
,
故答案为: ;
;
(3)1molH2燃烧放出的热量为a kJ×$\frac{1mol×2g/mol}{1g}$=2a kJ,故氢气燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O (l)△H=一2a kJ•mol-1,
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O (l)△H=一2a kJ•mol-1;
(4)X与Y形成的18电子分子为H2O2、X与M形成的18电子分子为H2S,这两种分子在水溶液中反应有黄色沉淀生成,即反应生成S与水,反应方程式为:H2O2+H2S=S↓+2H2O,
故答案为:H2O2+H2S=S↓+2H2O;
(5)H3O+离子中O原子孤电子对=$\frac{6-1-1×3}{2}$=1,价层电子对数=3+1=4,立体结构为三角锥形;
化合物A为Cu元素的二价离子与H2O分子构成的配位数为4的络合物,该配离子为[Cu(H2O)4]2+,A的水溶液呈现天蓝色,逐滴加入氨水,形成蓝色沉淀为Cu(OH)2,后蓝色沉淀溶解生成[Cu(NH3)4]2+,反应离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:三角锥形;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(6)均由X、Y、Z、M四种元素组成的两种盐为NaHSO3、NaHSO4,二者反应生成硫酸钠、二氧化硫与水,反应离子方程式为:HSO3-+H+=H2O+SO2↑,
故答案为:HSO3-+H+=H2O+SO2↑;
(7)已知Q是面心立方晶体,以顶点Q原子研究,与之相邻的Q原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,晶胞中Q原子的配位数是$\frac{3×8}{2}$=12;
若Q原子的半径为r,则晶胞棱长为4r×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r,则晶胞体积为(2$\sqrt{2}$r)3,晶胞中Q原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞中Q原子占有的总体积为4×$\frac{4}{3}$πr3,晶胞中原子的空间利用率=$\frac{4×\frac{4}{3}π{r}^{3}}{(2\sqrt{2}r)^{3}}$×100%=74%,
故答案为:12;74%.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、分子结构与性质、热化学方程式、电子式、空间结构、配合物、元素化合物性质、晶胞计算等,需要学生具备扎实的基础,掌握均摊法进行晶胞有关计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实 验 操 作 | 结 论 |
| A | 用容量瓶配制溶液时,若定容摇匀后液面低于刻度线,补加水至与刻度线相平 | 所配溶液浓度不受影响 |
| B | 用湿润的pH试纸测定氯水的pH | 所测溶液的pH偏大 |
| C | 取少量试液于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 若红色石蕊试纸变蓝 则所取溶液含NH4+ |
| D | 用托盘天平称取一定质量的NaCl固体,左盘放砝码,右盘放固体 | 所称NaCl质量一定偏小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气分子内每个氢原子都达到了8电子稳定结构 | |
| B. | 1 mol H2的能量比2 mol H的能量低 | |
| C. | 1 mol H2离解成2 mol H要放出437.6 kJ热量 | |
| D. | 氢原子不如氢分子活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H30 | B. | C15H32 | C. | C16H34 | D. | C17H36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成后变为蓝色沉淀 | Cu(OH)2的Ksp比Mg(OH)2的小 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| C | 向盛Na2SiO3 溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| D | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状碳 | 浓硫酸具有吸水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
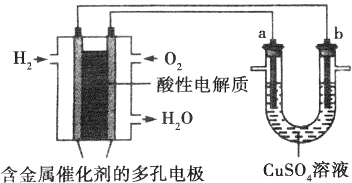
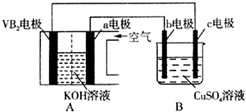 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池电解200mL硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.04mol电子时,B装置两极共收集到0.448L气体(标准状况).下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池电解200mL硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.04mol电子时,B装置两极共收集到0.448L气体(标准状况).下列说法正确的是( )| A. | 电解过程中,b电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2为负极,电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ | |
| C. | 电池内部OH-移向a电极,溶液pH减小 | |
| D. | 忽略溶液体积变化,电解后B装置中溶液的pH为1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com