
【题目】药物比卡鲁安(G)可以通过以下方法合成:

(1)B 中的含氧官能团名称为__________________;
(2)B→C 的反应类型为___________________;
(3)写出同时满足下列条件的 D 的一种同分异构体的结构简式:__________________;
①有苯环;②能使溴的 CCl4 溶液褪色;③分子中有 2 种不同化学环境的氢
(4)合成 F 时还可能生成一种副产物 X,X 的结构简式为___________________;
(5)已知 : 苯胺 (![]() ) 易被氧化,请以甲苯和甲醇为原料制备
) 易被氧化,请以甲苯和甲醇为原料制备 。_____________________
。_____________________
【答案】 硝基 还原反应 

【解析】⑴.从B的结构可以看出,B中的含氧官能团是硝基,故答案是:硝基;
⑵. B→C 的反应过程中,硝基变成了氨基,在有机反应中,加氢或去氧的反应为还原反应,故答案是:还原反应;
⑶.①有苯环,说明分子中的苯环无变化;②能使溴的 CCl4 溶液褪色,说明分子中含有不饱和键;③分子中有 2 种不同化学环境的氢,说明分子结构应为对称结构,则两个氮原子应形成2个氨基,且形成一个碳碳三键,故其结构简式为: ,故答案为:
,故答案为: ;
;
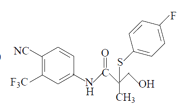
⑷.E与![]() 发生的是醚键断裂开环,S可以和与O原子相连的两个碳原子中的任何一个连接,发生加成反应,所以产物可以是F,也可以是
发生的是醚键断裂开环,S可以和与O原子相连的两个碳原子中的任何一个连接,发生加成反应,所以产物可以是F,也可以是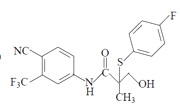 ,故答案为:
,故答案为: ;
;
⑸.以甲苯和甲醇为原料制备 时,可以用甲苯氧化生成苯甲酸,再与甲醇发生酯化生成苯甲酸甲酯;同时用甲苯与浓硝酸发生硝化反应生成对硝基甲苯,在氯化锡的作用下生成对氨基甲苯,对氨基甲苯与苯甲酸发生酯化反应生成
时,可以用甲苯氧化生成苯甲酸,再与甲醇发生酯化生成苯甲酸甲酯;同时用甲苯与浓硝酸发生硝化反应生成对硝基甲苯,在氯化锡的作用下生成对氨基甲苯,对氨基甲苯与苯甲酸发生酯化反应生成![]() ,再用酸性高锰酸钾氧化生成
,再用酸性高锰酸钾氧化生成 ,故合成路线为:
,故合成路线为: 。
。


科目:高中化学 来源: 题型:
【题目】通过下列反应从硫化物中提取单质锑。
①2Sb2S3+6Fe+3O2![]() Sb4O6+6FeS ②Sb4O6+6C
Sb4O6+6FeS ②Sb4O6+6C![]() 4Sb+6CO↑
4Sb+6CO↑
关于反应①、②的说法不正确的是( )
A. 反应①中被氧化的元素是Sb和Fe
B. 反应①中每生成2molFeS时共转移4mol电子
C. 反应②说明高温下C的还原性比Sb强
D. 每生成2molSb时,反应①与反应②中还原剂的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol/L的Na2SO4溶液是 ( )
A. 溶液中含有1mol Na2SO4
B. 1升水中加入142g Na2SO4
C. 1mol Na2SO4溶于1mol水中
D. 将322g Na2SO4·10H2O溶于少量水后再稀释成1000mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18 g·mL-1,质量分数为36.5%浓盐酸配制250 mL 0.1 mol·L-1 的盐酸,填空并回答下列问题:
(1)配制250 mL 0.1 mol·L-1的盐酸___________。
应称量盐酸体积/mL | 应选用容量瓶的规格/mL | 容量瓶外还需的其他仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___________。
A.用30 mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是___________,溶液注入容量瓶前需恢复到室温,这是因为___________;
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线___________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1∶1,完成下列方程式:____Mo+____HF+____HNO3=____ MoO2F2+____ MoOF4+____NO2↑+____ _________
(2)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =_________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(3)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH__0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=______(MPa)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学反应方程式___________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式___________;H2还原SiHCl3过程中若混有O2,可能引起的后果是___________。
(2)下列有关硅材料的说法正确的是___________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在pH =5的稀醋酸溶液中,c(CH3COO-)=_______________________(不必化简)。下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是_________________
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)________________V(醋酸),反应的最初速率为:υ(盐酸)___________υ(醋酸)。(填写“>”、“<”或“=”)
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系为:_________________。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为__________________________________。
(5)已知:90℃时,水的离子积常数为Kw=3.8×10-13,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=______________(保留三位有效数字)mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com