
分析 A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.
A的质子数、电子层数、最外层电子数均相等,则A为H元素;
B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,电子排布为1s22s22p2,则B为C元素;
D的基态原子核外成对电子数是成单电子数的3倍,则D为O元素,故C为N元素;
E4+与氩原子的核外电子排布相同,则E为Ti元素;
F是第四周期d区原子序数最大的元素,则F为Ni元素,据此解答.
解答 解:A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.
A的质子数、电子层数、最外层电子数均相等,则A为H元素;
B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,电子排布为1s22s22p2,则B为C元素;
D的基态原子核外成对电子数是成单电子数的3倍,则D为O元素,故C为N元素;
E4+与氩原子的核外电子排布相同,则E为Ti元素;
F是第四周期d区原子序数最大的元素,则F为Ni元素,
(1)E为22号元素Ti,其价层电子排布式为3d24s2,
故答案为:3d24s2;
(2)同周期元素从左到右电负性逐渐增大,电负性由大到小的顺序为O>N>C>H,
故答案为:O>N>C>H;
(3)Ni(CO)4熔沸点较低,为分子晶体;Ni为过渡元素容易提供空轨道,而CO提供孤对电子,二者形成配位键,
故答案为:分子晶体;配位键;
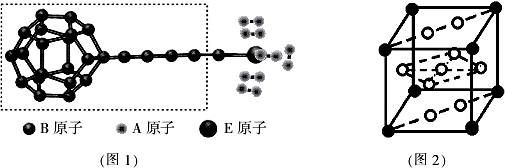
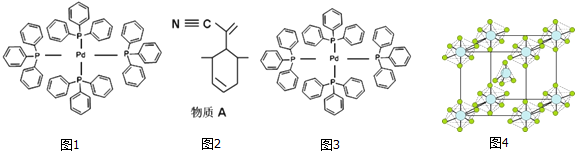
(4)①图中虚线框内碳原子之间的化学键有C-C、C=C、C≡C,其杂化类型分别为sp3杂化、sp2杂化、sp杂化,所以杂化轨道类型有3种,
故答案为:3;
②CH4分子间没有氢键不能形成“笼状结构”,每个HF只能形成2个氢键,所以HF分子间只能形成链状结构,
故答案为:BC;
③该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以晶胞实际含有的镍原子为1+8×$\frac{1}{2}$=5,晶胞实际含有的镧原子为8×$\frac{1}{8}$=1,所以晶体的化学式LaNi5,晶胞的密度ρ=$\frac{m}{V}$=$\frac{M}{{N}_{A}×(a×1{0}^{-10}cm)^{3}}$=$\frac{M}{{N}_{A}•{a}^{3}}×1{0}^{30}$,
故答案为:LaNi5;$\frac{M}{{N}_{A}•{a}^{3}}×1{0}^{30}$.
点评 题目综合性较大,涉及电负性、晶体、化学键、杂化轨道、晶胞计算等,难度中等,注意运用杂化理论推导分子构型.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 300 | 727 | 1 227 |
| lg K | 6.17 | 2.87 | 1.24 |
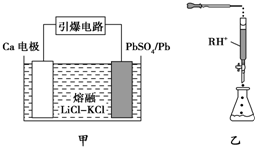
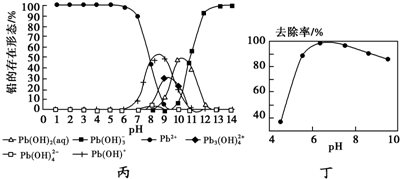
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
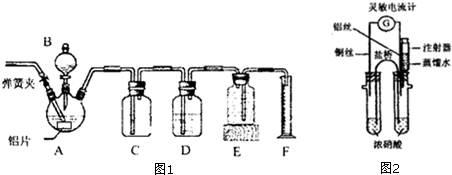
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L臭氧与22.4L氢气所含原子数均为2NA | |
| B. | 46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 2.24LCH4所含电子数为NA | |
| D. | 1molO2参加反应转移的电子数一定为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
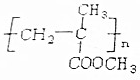 ,此物质与氢氧化钠共热后加入盐酸,能得到两种有机产物,下列物质与产物之一互为同分异构体( )
,此物质与氢氧化钠共热后加入盐酸,能得到两种有机产物,下列物质与产物之一互为同分异构体( )| A. | 丁酸 | B. | CH2=CHCH2COOH | C. | 甲酸丙酯 | D. | 丙烯酸甲酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com