
| A. | 在外加电场的作用下,胶体发生电泳现象,说明胶体是带电荷的 | |
| B. | 水的沸点比硫化氢的沸点高,是因为水分子内形成了氢键 | |
| C. | 晶体中有阴离子就一定有阳离子 | |
| D. | 有单质参加或生成的反应一定是氧化还原反应 |
分析 A、胶体不带电;
B、氢键是一种较强的分子间作用力;
C、晶体中存在阴离子则一定含阳离子;
D、有单质参加的反应不一定是氧化还原反应.
解答 解:A、胶体不带电,带电的是胶粒,故A错误;
B、氢键是一种较强的分子间作用力,存在于水分子之间,而不是分子内,故B错误;
C、晶体中存在阴离子则一定含阳离子,但存在阳离子不一定含阴离子,如金属晶体,故C正确;
D、有单质参加的反应不一定是氧化还原反应,如氧气和臭氧之间的转化,有单质参加和生成,但不是氧化还原反应,故D错误.
故选C.
点评 本题考查了胶体的性质、氢键的存在和晶体的构成等,难度不大,应注意的是晶体中存在阴离子则一定含阳离子,但存在阳离子不一定含阴离子.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有 x+1 | B. | 可能是 x+8或 x+18 | ||
| C. | 可能是 x+2 | D. | 可能是 x+1或 x+11或x+25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
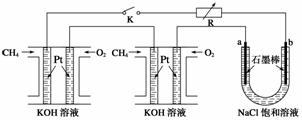 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是放热反应的发生均无需加热 | |
| B. | 物质发生化学反应都伴随着能量变化 | |
| C. | 凡是需要加热后才能发生的反应是吸热反应 | |
| D. | 伴有能量变化的物质变化都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
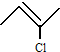 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
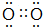 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com