
| A. | 酸性氧化物不一定都能与水反应生成酸 | |
| B. | 某溶液加入盐酸酸化的BaCl2溶液产生白色沉淀,则原溶液中含有SO42- | |
| C. | 丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 现代化学分析测试常借助一些仪器来分析物质组成,如用原子吸收光谱确定物质中含有那些金属元素 |
分析 A.酸性氧化物为能和碱反应生成盐和水的氧化物,不一定都与水反应生成相应的酸;
B.白色沉淀可能为AgCl;
C.胶体具有丁达尔现象,溶液无此现象;
D.不同元素的原子发生跃迁时会吸收不同的,形成特征谱线.
解答 解:A.酸性氧化物不一定都与水反应生成相应的酸,如SiO2不溶于水,但是二氧化硅是酸性氧化物,故A正确;
B.原溶液中含有Ag+,也会有白色沉淀生成,则应先加盐酸酸化,排除干扰,再加氯化钡检验硫酸根离子,故B错误;
C.FeCl3溶液不存在丁达尔现象,Fe(OH)3胶体中存在丁达尔现象,丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体,故C正确;
D.不同元素的原子发生跃迁时会吸收不同的,形成特征谱线,所以现代化学分析测试中用原子吸收光谱确定物质中含有哪些金属元素,故D正确;
故选B.
点评 本题考查酸性氧化物性质、离子检验、胶体的鉴别、物质组成分析等,注重高频考点的考查,题目难度不大.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
 |  |  |  |
| ① | ② | ③ | ④ |
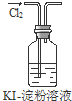
| A. | 实验①中溶液出现蓝色 | |
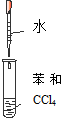
| B. | 实验②试管出现分层现象,上下为油层,中间为水层 | |
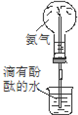
| C. | 实验③中烧瓶内溶液变红色 | |
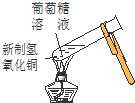
| D. | 实验④中出现砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
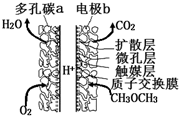 一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )
一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )| A. | 多孔碳a能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 电极b上发生的反应为:CH3OCH3-12e-+3H2O═2CO2+12H+ | |
| C. | H+由b电极向a电极迁移 | |
| D. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇(CH3OH)直接燃料电池能量密度的1.4倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl、AgBr、AgI均是难溶于水的固体,且要避光保存于棕色瓶中 | |
| B. | AgCl是白色难溶于水的固体,用于指纹鉴定有助于警察破案 | |
| C. | AgBr是黑色光敏性物质,常用于制作胶卷和人工降雨 | |
| D. | AgI是黄色固体,见光容易分解为单质碘和黑色的单质银,还常用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热的方法区分纯碱和小苏打 | |
| B. | 用量筒量取5.0mL浓硫酸,并直接加水稀释 | |
| C. | 用分液漏斗分离苯和水的混合物 | |
| D. | 用托盘天平称量药品时,左盘放物品,右盘放砝码 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池可将热能直接转变为电能 | |
| B. | 铁制品上镀铜时,镀件为阳极,铜盐为电镀液 | |
| C. | 镀锌铁皮的镀层损坏后,铁更容易腐蚀 | |
| D. | 铅蓄电池充电时Pb极与外电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
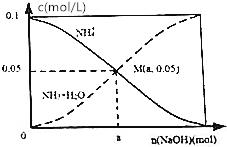 常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )
常温下,向1L 0.1mol•L-1NH4Cl溶液中,不断加入NaOH固体后,NH4+与NH3•H2O浓度的变化趋势如图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(0H-)-n(H+)=(a-0.05)mol | |
| C. | 随着Na0H的加入,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$不断减小 | |
| D. | 当n(NaOH)=0.1mol时,c(0H-)>c(C1-)>c(NH3•H20) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com