
【题目】研究 CO2的利用对促进低碳社会的构建具有重要意义。
(1)一定条件下,在 CO2 与足量碳反应所得平衡体系中加入 H2 和适当催化剂,有下列反应发生:CO(g)+3H2(g) ![]() CH4(g)+H2O(g) H1=-206.2kJ/mol ;CO(g)+H2O(g)
CH4(g)+H2O(g) H1=-206.2kJ/mol ;CO(g)+H2O(g)![]() CO2(g)+H2(g)H2若 CO2 和 H2 反应生成 0.1mol CH4(g)和一定量的 H2O(g), 整个过程中放出的热量为 16.5kJ, 则△H2=__________。
CO2(g)+H2(g)H2若 CO2 和 H2 反应生成 0.1mol CH4(g)和一定量的 H2O(g), 整个过程中放出的热量为 16.5kJ, 则△H2=__________。
(2)为研究 CO2 与 CO 之间的转化。让一定量的 CO2 与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H。 测得压强、温度对 CO 的体积分数(φ(CO)%)的影响如图所示:
2CO(g) H。 测得压强、温度对 CO 的体积分数(φ(CO)%)的影响如图所示:
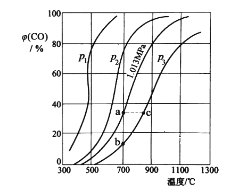
回答下列问题:
① p1、p2、p3 的大小关系是__________,图中 a、b、c 三点对应的平衡常数大小关系是__________(用 Ka、Kb、Kc 表示)。
② 900 ℃、1.013 MPa 时,1 mol CO2 与足量碳反应达平衡后容器的体积为VL,CO2 的转化率为__________,(保留一位小数)该反应的平衡常数 K=__________。
③将②中平衡体系温度降至 640 ℃,压强降至 0.1013 MPa,重新达到平衡后 CO2 的体积分数为 50%。条件改变时,正反应和逆反应速率如何变化?__________,二者之间有何关系?__________。
(3)CO2 可用于工业制备草酸锌,其原理如下图所示(电解液不参加反应),Zn 电极是__________极。已知在 Pb 电极区得到 ZnC2O4,则 Pb 电极上的电极反应式为__________。

【答案】-41.2 kJ/mol p1<p2<p3 Ka=Kb<Kc 66.7% ![]() mol/L 正反应和逆反应速率均减小 v(正)<v(逆) 阳 2CO2+2e-=C2O42-
mol/L 正反应和逆反应速率均减小 v(正)<v(逆) 阳 2CO2+2e-=C2O42-
【解析】
(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:① CO(g)+3H2(g)CH4(g)+H2O(g)△H1=-206.2 kJ/mol;②CO(g)+H2O(g)CO2(g)+H2(g)△H2;若H2还原CO2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则H2还原CO2生成1molCH4(g)和一定量的H2O(g),放出热量为165kJ,该反应的热化学方程式为:③CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H3=-165kJ/mol,根据盖斯定律,①-③可得②,据此计算△H2;
(2)①反应C(s)+CO2(g)2CO(g)是气体分子数增多的反应,随着反应进行,体系压强增大;化学平衡常数只随温度的改变而改变;
②900℃、1.013MPa时,平衡时CO的体积分数为80%,计算CO2转化的量,转化率就是转化的量与起始量比值的百分数,将各组分的平衡浓度代入平衡常数表达式计算化学平衡常数;
③根据改变条件前后CO2的体积分数的变化判断,根据反应商判断化学反应的方向;
(3)Zn在阳极上失电子生成锌离子,Pb电极上CO2得电子生成C2O42-。
(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:①CO(g)+3H2(g)CH4(g)+H2O(g)△H1=-206.2 kJ/mol;②CO(g)+H2O(g)CO2(g)+H2(g)△H2;若H2还原CO2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则H2还原CO2生成1molCH4(g)和一定量的H2O(g),放出热量为165kJ,该反应的热化学方程式为:③CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H3=-165kJ/mol,根据盖斯定律,①-③可得②:②CO(g)+H2O(g)CO2(g)+H2(g)△H2=(206.2 kJ/mol)(165kJ/mol)=41.2kJ/mol;
故答案为:41.2kJ/mol;
(2)①反应C(s)+CO2(g)2CO(g)是气体分子数增多的反应,随着反应进行,体系压强增大,减小压强有助于化学平衡正向移动,表明低压强对应着高的CO体积分数,则p1、p2、p3的大小关系是:p1<p2<p3;化学平衡常数只随温度的改变而改变,升高温度,正反应趋势增大,化学平衡常数增大,则a、b、c三点对应的平衡常数大小关系是:Ka=Kb<Kc;
故答案为:p1<p2<p3;Ka=Kb<Kc;
②900℃、1.013MPa时,设反应转化的CO2的物质的量为xmol,则平衡时n(CO)=2x,n(CO2)=1x,平衡时CO的体积分数为80%,则![]() ×100%=80%,解得:x=2/3,则CO2的转化率为:2/3mol/1mol×100%=66.7%;平衡时,c(CO)=
×100%=80%,解得:x=2/3,则CO2的转化率为:2/3mol/1mol×100%=66.7%;平衡时,c(CO)= ![]() =
=![]() ,c(CO2)=
,c(CO2)= ![]() =
=![]() ,则该反应的平衡常数K=
,则该反应的平衡常数K= 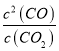 =
=![]() mol/L;
mol/L;
故答案为:66.7%;![]() mol/L;
mol/L;
③反应C(s)+CO2(g)2CO(g)是吸热反应,气体分子数增大的反应,降低压强,升高温度均有利于反应正向进行,将(2)中平衡体系温度降至640℃,压强降至0.1013 MPa,降低温度减小压强,均使正逆反应速率减小;重新达到平衡后CO2的体积分数为50%,设反应转化的CO2的物质的量为ymol,则平衡时n(CO2)=1y,n(CO)=2y,则:![]() =50%,可得y=
=50%,可得y=![]() ,可见重新达到平衡时,体系中CO含量降低,CO2含量升高,化学平衡向逆反应方向移动,所以v(逆)>v(正);
,可见重新达到平衡时,体系中CO含量降低,CO2含量升高,化学平衡向逆反应方向移动,所以v(逆)>v(正);
故答案为:正逆反应速率均减小;>;
(3)利用电化学还原CO2制取ZnC2O4,则Zn失电子,所以Zn在阳极上失电子生成锌离子,即锌与正极相连为阳极;Pb电极上CO2得电子生成C2O42,则其电极反应为:2CO2+2e=C2O42-;
故答案为:阳;;2CO2+2e-=C2O42-。


科目:高中化学 来源: 题型:
【题目】25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10—10),下列说法正确的是
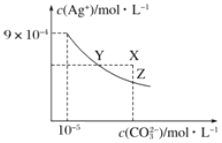
A.根据图示可计算出Ksp(Ag2CO3)=9×10—9
B.向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点
C.反应Ag2CO3(s)+2Cl—(aq)![]() 2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108
2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108
D.将0.001mol/LAgNO3溶液滴入浓度均为0.001mol/L的KCl和K2CO3的混合溶液,CO32—先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图填空:

反应物是________;生成物是________。在2 min内A、B、C三者的反应速率值分别是____________、____________、____________,该反应的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法中正确的是
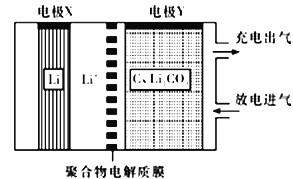
A. 该电池放电时,Li+向电极X方向移动
B. 该电池充电时,每转移0.4mol电子,理论上阳极产生4.48L.CO2
C. 该电池放电时,每转移4mol电子理论上生成1molC
D. 该电池充电时,阳极反应式为C+2Li2CO3-4e-==3CO2↑+4Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
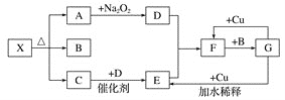
(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置可以制备无水氯化铁。下列有关说法正确的是( )
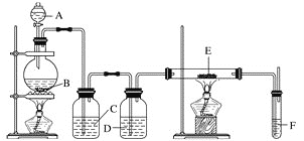
A. 烧瓶B中制备氯气的反应物为MnO2和稀盐酸
B. 装置C、D中分别盛有浓硫酸、饱和食盐水
C. 装置E和装置F之间需要增加一个干燥装置,才能制得无水氯化铁
D. 装置F的目的是检验有无氯气逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物对香豆酸(![]() )主要用于配置香辛樱桃、杏、蜂蜜等香料.
)主要用于配置香辛樱桃、杏、蜂蜜等香料.
(1)下列关于对香豆酸的说法不正确的是___.
a.能与NaOH溶液反应 b.能发生加成、取代、银镜反应
c.加金属钠,有氢气生成 d.加FeCl3溶液,溶液显紫色
(2)对香豆酸的某种同分异构体丁,可用于除草剂苯嗪草酮的中间体,其可通过下图转化关系制得.
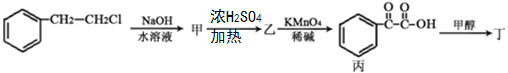
①甲→乙的反应类型_______;乙→丙的反应类型_______;
②甲分子所含官能团是_____(填名称);乙的结构简式:______________;
③丙→丁的反应化学方程式:___________________________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com