
分析 (1)安全气囊内的NaH发生化学反应生成金属钠与氢气,反应方程式为:2NaH═2Na+H2↑,一种物质转化为两种物质;
(2)根据n=$\frac{m}{M}$,计算96gNaH的物质的量;
(3)根据方程式计算生成氮气的物质的量,再根据V=nVm计算氮气的体积;
(4)结合n=$\frac{m}{M}$、c=$\frac{n}{V}$计算.
解答 解:(1)安全气囊内的NaH发生化学反应生成金属钠与氢气,反应方程式为2NaH═2Na+H2↑,一种物质转化为两种物质,所以是分解反应,
故答案为:2NaH═2Na+H2↑;分解反应;
(2)96gNaH的物质的量=$\frac{96g}{24g/mol}$=4mol,故答案为:4mol;
(3)96g NaH完全分解,设生成氢气的物质的量为n,则:
2NaH═2Na+H2↑,
2 1
4mol n
n=2mol,
故标况下生成氮气的体积=2mol×22.4L/mol=44.8L,
故答案为:44.8L;
(4)n(KOH)=$\frac{28g}{56g/mol}$=0.5mol,设水的物质的量为x,每200个水分子中有1个K+,
$\frac{200}{1}=\frac{x}{0.5mol}$,解得x=100mol,
水的质量为18g/mol×100mol=1800g,
所得溶液的密度为ρg/cm3,则该溶液中OH-的物质的量浓度为$\frac{0.5mol}{\frac{1800g+28g}{ρ}×1{0}^{-3}L}$=0.27ρ mol/L,
故答案为:1800;0.27ρ mol/L.
点评 本题考查物质的性质及化学反应的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
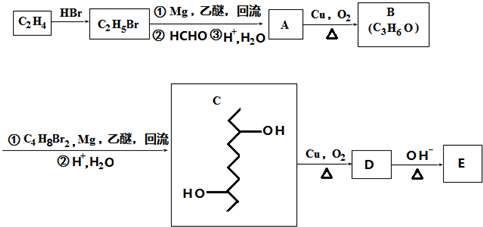
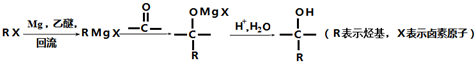

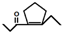 ,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式
,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式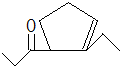 、
、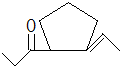 .
.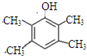 或
或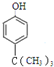
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
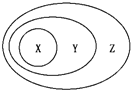
| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 溶液 | 分散系 | 混合物 |
| B | 铜 | 金属元素 | 元素 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是短周期元素中原子半径最大的 | |
| B. | X元素最高价氧化物对应的水化物,可以与其他三种元素最高价氧化物对应的水化物反应 | |
| C. | WZ4分子中每个原子最外层均达到8电子结构 | |
| D. | X元素的氧化物中只存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
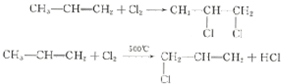
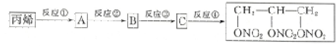
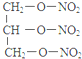 +3H2O.
+3H2O.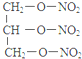 +5O2$\stackrel{酶}{→}$12CO2+10H2O+12NO.
+5O2$\stackrel{酶}{→}$12CO2+10H2O+12NO.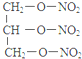 $\stackrel{加热或振动}{→}$12CO2+10H2O+2NO+5N2.
$\stackrel{加热或振动}{→}$12CO2+10H2O+2NO+5N2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z |
| A. | X、Y的最高价氧化物溶于水后的溶液一定显酸性 | |
| B. | 原子半径由大到小的顺序:Z>X>Y | |
| C. | Z的简单离子对水的电离没有影响 | |
| D. | Z的氯化物与氧化物都属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何状况下,78克过氧化钠的分子数为NA | |
| B. | 标况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标况下,22.4L水中含水分子为NA | |
| D. | 含NA个Na+的Na2O溶解于水配成1L溶液中,Na+的物质的量浓度为1mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com