
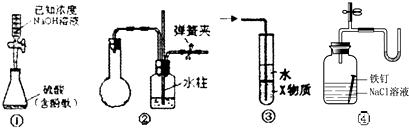
| A、装置①是中和滴定法测定硫酸的物质的量浓度 |
| B、装置②中手捂烧瓶(橡胶管已被弹簧夹夹紧),发现导管中有液柱上升并保持稳定,则说明装置不漏气 |
| C、装置③中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
| D、装置④证明铁生锈过程中空气参与反应 |


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
| A、在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 |
| B、人们常采用牺牲阳极保护法防止通讯电缆发生腐蚀 |
| C、在电镀槽中,镀件做阴极,阳极选用镀层金属 |
| D、用惰性电极电解某硫酸铜溶液一段时间后,要恢复溶液的成分和浓度,可向溶液中加入一定量的氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N5+有24个电子 |
| B、N5+离子中存在三对未成键的电子对 |
| C、N5+阳离子中存在两个氮氮三键 |
| D、N5+在水中可以稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解质的水溶液中存在电离平衡.
电解质的水溶液中存在电离平衡.| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol?L-1 AgNO3溶液中加入2mL 0.005mol?L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol?L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol?L-1AgNO3溶液. | |
| 步骤4:向步骤1余下的浊液中加入5滴3mol?L-1KI溶液. | 出现黄色沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:
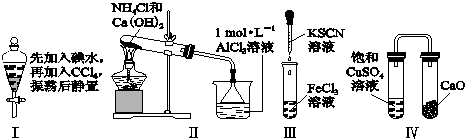
| A、实验Ⅰ:液体分层,下层呈无色 |
| B、实验Ⅱ:烧杯中先出现白色沉淀,后溶解 |
| C、实验Ⅲ:试管中立刻出现红色沉淀 |
| D、实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+ |
| B、Na+ |
| C、OH- |
| D、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、松花蛋是一种常用食品,食用时有氨的气味,可以蘸些食醋除去 |
| B、“皮革奶”是奶粉中掺入皮革下脚料,将皮革灼烧时有烧焦羽毛的气味 |
| C、腌制食品中应严格控制NaNO2的用量 |
| D、从海水中可提取Mg,用惰性电极电解熔融的MgCl2或其水溶液都可制得Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若使溶液恢复到电解前的浓度可以向溶液中加20(10-b-10-a)g CuO |
| B、b<a<7 |
| C、阳极电极反应:4OH--4e-═2O2↑+4H+ |
| D、整个过程中是阳极产生氧气,阴极析出铜单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com