
| A. | LiCl | B. | NCl3 | C. | PCl5 | D. | BF3 |
分析 在ABn型化合物中,中心元素A的族序数+成键数=8时,满足分子中所有原子都满足最外层8电子结构,含H元素的化合物一定不满足,以此来解答.
解答 解:A.LiCl中,Li离子最外层电子数为2,不满足8电子稳定结构,故A错误;
B.NCl3中,N元素位于第ⅤA族,则5+3=8,满足分子中所有原子都满足最外层8电子结构,故B正确;
C.PCl5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,分子中P原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以|-1|+7=8,分子中Cl原子满足8电子结构,故C错误;
D.BF3中,B元素位于第ⅢA族,则3+3≠8,不满足分子中所有原子都满足最外层8电子结构,故D错误;
故选B.
点评 本题考查原子核外电子数的计算,题目难度不大,明确元素的位置、最外层电子数、成键数即可判断,注意掌握原子核外电子排布特点,试题培养了学生的灵活应用能力.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
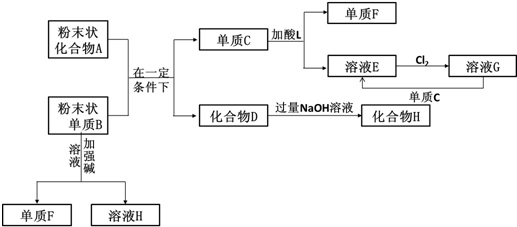
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
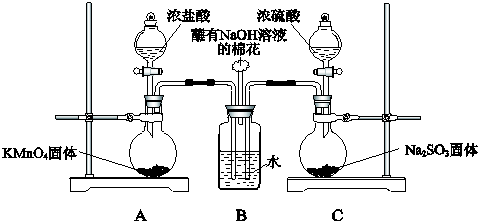
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向1mol•L-1的氨水中加少里硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液②NH4HCO3溶液③NH4Cl溶液④(NH4)2Fe(SO4)2溶液液中,c(NH${\;}_{4}^{+}$)的大小关系:④>①>③>② | |
| C. | 将2mol•L-1的某一元酸HA溶液和1mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(HA) | |
| D. | 物质的量浓度之比为 1:1 的NaClO、NaHCO3混合溶液中:c(HC10)+c(ClO-)=c(C0${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.
已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与AlCl3溶液反应发生的离子方程式为 Al3++3OH-═Al(OH)3↓ | |
| B. | 用HNO3溶液完全中和后,溶液不显中性 | |
| C. | 加水稀释后,溶液中c(NH${\;}_{4}^{+}$)•c(OH-)变大 | |
| D. | 1L0.1mol•L-1的氨水中有6.02×1022个NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
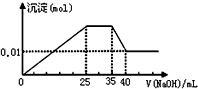 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:| A. | 原溶液一定不存在H+、Cu2+、CO32-、Fe3+ | |
| B. | 不能确定原溶液是否含有K+、NO3- | |
| C. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH的浓度为2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
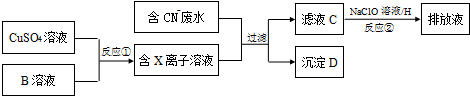
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素 | |
| B. | 原子序数为48的元素 | |
| C. | 原子核外L层比M层多一个电子的元素 | |
| D. | 原子核外M层有8个电子的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com