
【题目】常温下,向20 mL 0.1 molL-1的MOH溶液中逐滴加入0.1 molL-1 HCl溶液,滴定曲线如图所示。请回答下列问题:
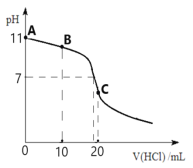
(1)请写出MOH的电离方程式__________________________,常温下,该碱的电离平衡常数Kb=_________。
(2)滴定到B点时,溶液中各离子浓度由大到小的顺序是_________________________。
(3)C点所对应的溶液呈_____性,用离子方程式表示其原因______________________。
(4)图中A、B、C三点溶液中水的电离程度由大到小的顺序是_______________________。
【答案】MOH![]() M++OH- 10-5 c(M+)>c(Cl-)>c(OH-)>c(H+) 酸 M++H2O
M++OH- 10-5 c(M+)>c(Cl-)>c(OH-)>c(H+) 酸 M++H2O![]() MOH+H+ C>B>A
MOH+H+ C>B>A
【解析】
(1)根据图像可知,溶液的pH=11,c(OH-)=10-3mol/L,MOH溶液的浓度为0.1 molL-1,MOH为弱碱;
(2)滴定到B点时,溶质为MOH、MCl,且物质的量相等,此溶液显碱性,即MOH的电离程度大于MCl的水解程度;
(3)根据图像可知,C点溶液为MCl溶液,其溶质为强酸弱碱盐,溶液显酸性;M离子水解生成MOH和氢离子;
(4)A点为MOH溶液,抑制水的电离;B点为MOH、MCl混合溶液,MOH抑制水的电离,MCl促进水的电离;C点为MCl,为盐溶液,促进水的电离。
(1)根据图像可知,溶液的pH=11,c(OH-)=10-3mol/L,MOH溶液的浓度为0.1 molL-1,MOH为弱碱,电离方程式为MOH![]() M++OH-;
M++OH-;
(2)滴定到B点时,溶质为MOH、MCl,且物质的量相等,此溶液显碱性,即MOH的电离程度大于MCl的水解程度,则c(M+)>c(Cl-)>c(OH-)>c(H+);
(3)根据图像可知,C点溶液为MCl溶液,其溶质为强酸弱碱盐,溶液显酸性;M离子水解生成MOH和氢离子,离子方程式为M++H2O![]() MOH+H+;
MOH+H+;
(4)A点为MOH溶液,抑制水的电离;B点为MOH、MCl混合溶液,MOH抑制水的电离,MCl促进水的电离;C点为MCl,为盐溶液,促进水的电离,则水的电离程度由大到小的顺序为C>B>A。


科目:高中化学 来源: 题型:
【题目】卡托普利E是用于治疗各种原发性高血压的药物,合成路线如图:

(1)A的结构简式是___,B中含氧官能团的名称是___。
(2)C→D的反应类型是___。
(3)下列关于卡托普利E说法正确的是___。
a.能发生取代反应 b.在氧气中充分燃烧的产物中含有SO2
c.能与Na反应生成氢气 d.E的分子式为C9H16NO3S
(4)已知:高分子H的结构简式为 。写出以B为原料(其它无机试剂任选),制备H的合成路线___(限定三步反应完成)。(用结构简式表示有机物。如:A
。写出以B为原料(其它无机试剂任选),制备H的合成路线___(限定三步反应完成)。(用结构简式表示有机物。如:A![]() B
B![]() ……)。
……)。
写出合成路线中最后一步反应的化学方程式___。
(5)D的消去产物F的结构简式为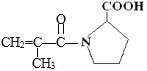 ,F有多种同分异构体,如
,F有多种同分异构体,如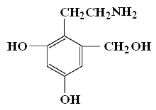 等。写出满足下列条件的F的同分异构体的结构简式___、___。
等。写出满足下列条件的F的同分异构体的结构简式___、___。
a.含有苯环,不含甲基
b.能与NaOH溶液以物质的量之比1:1完全中和
c.苯环上一氯代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列5中离子中的某几种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为确认该溶液组成进行如下实验:
为确认该溶液组成进行如下实验:![]() 取
取![]() 该溶液,加入
该溶液,加入![]() 溶液,有白色沉淀、无刺激气味气体生成.过滤、洗涤、干燥,得沉淀
溶液,有白色沉淀、无刺激气味气体生成.过滤、洗涤、干燥,得沉淀![]() 再将滤液稀释至100ml,测得滤液中
再将滤液稀释至100ml,测得滤液中![]() 为
为![]() 另取
另取![]() 该溶液,加入足量的
该溶液,加入足量的![]() 溶液,生成白色沉淀
溶液,生成白色沉淀![]() 由此可得出关于原溶液组成的正确结论是
由此可得出关于原溶液组成的正确结论是![]()
A.一定含![]() 、
、![]() 、
、![]() ,不含
,不含![]() 、
、![]()
B.一定含![]() 、
、![]() 、
、![]() ,不含
,不含![]() ,可能含有
,可能含有![]()
C.![]() 为
为![]() ,
,![]() 为
为![]()
D.![]() 为
为![]() ,
,![]() 为
为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体
现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体![]() ;②第二份加足量
;②第二份加足量![]() 溶液后,得干燥沉淀
溶液后,得干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 根据上述实验,以下推测正确的是
根据上述实验,以下推测正确的是![]()
A.一定不存在![]() ,
,![]() 可能存在
可能存在
B.![]() 一定存在,
一定存在,![]() 可能存在
可能存在
C.![]() 一定存在
一定存在
D.一定不存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种半导体材料,属于稀散金属,被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”,是当代高技术新材料的支撑材料。以碲化亚铜渣(主要物相为Cu2Te、Cu、CuSO45H2O、Au、Ag等)为原料提取与制备TeO2和单质Te的工艺流程如图所示:
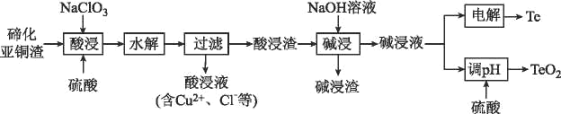
已知:“水解”反应为H2TeO3(亚碲酸)=TeO2↓+H2O。
回答下列问题:
(1)Cu2Te中Te的化合价为___。
(2)“酸浸”时,要使6molCu溶解,与Cu反应的NaC1O3的物质的量为___。
(3)写出“酸浸”时Cu2Te发生转化的离子方程式:___。
(4)取碲化亚铜渣100g,氯酸钠添加质量和硫酸浓度对碲化亚铜渣浸出效果的影响如图所示:

选择最佳的氯酸钠添加质量为___g,选择硫酸的浓度约为___mol/L(保留小数点后一位)。
(5)“碱浸渣”中含有的金属单质主要有___(填化学式),具有很高的经济利用价值。
(6)“碱浸液”利用硫酸调节溶液pH至5.5,沉淀出TeO2,该过程的离子方程式为____。
(7)电沉积法是工业中制备纯Te的常用方法,以不锈钢板和普通铁板作阴、阳极,在一定的电流密度、温度下电解碱浸液,碲元素以金属Te形式在阴极析出,则阴极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由含碘废水制取碘酸钾的一种工艺如下:

(1)H2O2的结构式为___。“制I2”过程中加入的硫酸不能过多的原因是_____。
(2)制CuI(s)步骤反应的离子方程式为_________。
(3)工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制___”。
(4)“制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于________。
(5)“制KIO3溶液”反应的离子方程式为______。
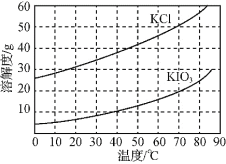
(6)KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一。
(1)氢氧燃料电池是一种高效无污染的清洁电池,用KOH溶液作电解质溶液,其负极反应式为_____________,理论上,正极消耗氧气2.8 L(标况下)时,电路中有__________mol e-通过。
(2)高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制双控开关,可交替得到H2和O2。
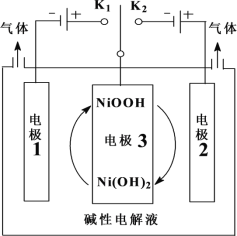
①太阳能光伏电池是将光能转化为__________能。
②当连接K1时可制得____________气体。
③当连接K2时,电极2附近pH_________(填“变大”、“变小”或“不变”)。
④当连接K2时,电极3作______极,其电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔加氢是乙烯工业中的重要精制反应,利用这一反应可以将乙烯产品中的乙炔含量降低,以避免后续乙烯聚合催化剂的中毒,工业上称为碳二加氢过程。
已知:Ⅰ.CH![]() CH(g)+H2(g)→CH2=CH2(g) ΔH1 K1(400K)=4.2×1022
CH(g)+H2(g)→CH2=CH2(g) ΔH1 K1(400K)=4.2×1022
Ⅱ.CH![]() CH(g)+2H2(g)→CH3CH3(g) ΔH2=-311.4kJ·mol-1 K2(400K)=1.4×1038
CH(g)+2H2(g)→CH3CH3(g) ΔH2=-311.4kJ·mol-1 K2(400K)=1.4×1038
回答下列问题:
(1)已知几种化学键的键能如下表所示:
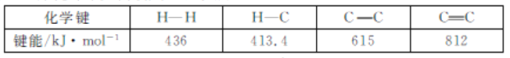
△H1=___kJmol-1。
(2)400K时,在密闭容器中将等物质的量的CH2=CH2(g)和H2(g)混合,采用适当的催化剂进行反应,生成CH3CH3(g),达到平衡时测得![]() =1016,则平衡时c(H2)=___molL-1。
=1016,则平衡时c(H2)=___molL-1。
(3)据前人研究发现乙炔在PV团簇表面催化加氢反应的部分历程如图1所示,其中吸附在PV表面上的物种用*标注。
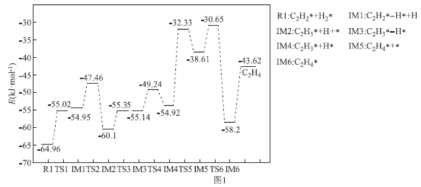
推测乙烯在PV表面上的吸附为___(填“放热”或“吸热”)过程。图1历程中最大能金(活化能)E正=___kJ·mol-1,该步骤的化学方程式为___。
(4)T1℃时,将体积比为1:2的CH≡CH(g)和H2(g)充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为P0 kPa,实验测得H2的分压(p)与反应时间(t)的关系如图2所示。
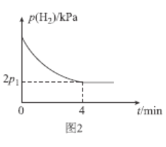
①T1℃时,0~4min内,平均反应速率v(HC≡CH)=___kPamin-1(用含p0、p1的代数式表示,下同)。
②T1℃时,该反应的化学平衡常数Kp=___kPa-2(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
③T1℃时,0~2min内p(H2)的减小量___(填“>”“<”或“=”)2~4min内p(H2)的减小量,理由为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 与 H2 合成(CH3)2O(二甲醚)是煤化工中的重要反应,有关信息如下:2CO2(g)+6H2(g) ![]() (CH3)2O(g)+3H2O(g) ΔH<0 恒容下,该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( ) (K 表示该反应的平衡常数)
(CH3)2O(g)+3H2O(g) ΔH<0 恒容下,该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( ) (K 表示该反应的平衡常数)
A.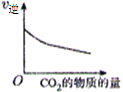 B.
B.
C.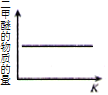 D.
D.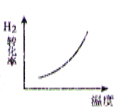
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com