
| m |
| M |
| N |
| NA |
| m |
| M |
| N |
| NA |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| A、(1)(2) |
| B、(3)(4) |
| C、(1)(3) |
| D、(2)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO═H++ClO- |
| B、HCO3-+H2O?H2CO3+OH- |
| C、Al(OH)3?Al3++3OH- |
| D、NaH2PO4?Na++H2PO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铝溶液中加入过量氨水Al3++3OH-═Al(OH)3↓ | ||||
| B、向水中通入氯气:Cl2+H2O=2H++Cl-+ClO- | ||||
C、MnO2与浓盐酸共热制Cl2:MnO2+4H++2Cl-
| ||||
| D、向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用数轴表示分散系的分类: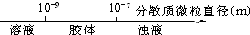 |
| B、已知氯酸钾与蔗糖(C12H22O11)反应的产物为KCl、CO2和水,则氧化产物与还原产物的物质的量之比为2:3 |
| C、10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% |
| D、可以用Ba(OH)2和焰色反应鉴别NaHCO3、NaCl、KCl、K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
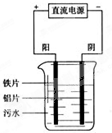 电浮选凝聚法是工业上采用的一种污水处理方法如图是电解污水装置示意图.
电浮选凝聚法是工业上采用的一种污水处理方法如图是电解污水装置示意图.查看答案和解析>>
科目:高中化学 来源: 题型:
 次氯酸钠(NaClO)和藏氯酸钠(NaClO)都是重要的含氯消毒剂.
次氯酸钠(NaClO)和藏氯酸钠(NaClO)都是重要的含氯消毒剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com