
 下列各种物质,有的具有多个官能团:请填写下列空白(填编号):
下列各种物质,有的具有多个官能团:请填写下列空白(填编号):分析 ①分子式符合CnH2n+2,属于烷烃;
②含有-COOH,属于羧酸类;
③含有碳碳双键,分子式符合CnH2n,属于烯烃;
④含有-OH,属于醇类,含有-COOH,属于羧酸类,虽含苯环,但不是芳香烃;
⑤分子式符合CnH2n+2,属于烷烃;
⑥含有酚羟基,属于酚类,含有醇羟基,属于醇类,虽含苯环,但不是芳香烃;
⑦含有-CHO,属于醛类,虽含碳碳双键,由于含有O,因此不是烯烃;
⑧分子中含有苯环的烃,属于芳香烃;
①和⑤都是烷烃,互为同系物.
解答 解:①分子式符合CnH2n+2,属于烷烃;
②含有-COOH,属于羧酸类;
③含有碳碳双键,分子式符合CnH2n,属于烯烃;
④含有-OH,属于醇类,含有-COOH,属于羧酸类,虽含苯环,但不是芳香烃;
⑤分子式符合CnH2n+2,属于烷烃;
⑥含有酚羟基,属于酚类,含有醇羟基,属于醇类,虽含苯环,但不是芳香烃;
⑦含有-CHO,属于醛类,虽含碳碳双键,由于含有O,因此不是烯烃;
⑧分子中含有苯环的烃,属于芳香烃;
①和⑤都是烷烃,互为同系物;
综上所述(1)属于烷烃的是①⑤;
(2)属于烯烃的是③;
(3)属于芳香烃的是⑧;
(4)属于醇类的是④⑥;
(5)属于羧酸类的是②④;
(6)属于酚类的是⑥;
(7)其中物质⑦中含有的官能团是碳碳双键、醛基;
(8)属于同系物的有①和⑤;
故答案为:(1)①⑤;
(2)③;
(3)⑧;
(4)④⑥;
(5)②④;
(6)⑥;
(7)碳碳双键、醛基;
(8)①和⑤.
点评 本题考查了常见有机物的分类,难度不大,熟知有机物的官能团是解题的关键,注意醇和酚类的区别.


科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 将氯气通入到水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-═CaCO3↓+H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
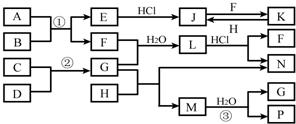 如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去).
如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去).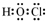 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 过量的氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 | |
| C. | 醋酸溶液中加入少量氢氧化钠:H++OH-═H2O | |
| D. | NaHCO3溶液与过量Ba(OH)2溶液混合:2HCO3-+2OH-+Ba2+═BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质A的转化率增大了 | B. | 平衡向正反应方向移动 | ||
| C. | 物质C的体积分数增大了 | D. | a+b<c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
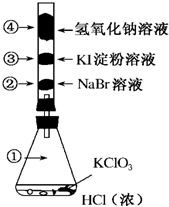 已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行氯、溴、碘的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行氯、溴、碘的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )| A. | ①黄绿色 ②橙色 ③蓝色 ④白色 | B. | ①无色 ②橙色 ③紫色 ④白色 | ||
| C. | ①黄绿色 ②橙色 ③蓝色 ④无色 | D. | ①黄绿色 ②无色 ③紫色 ④白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO32--4e-=4CO2
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO32--4e-=4CO2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com