
分析 配制950mL 2mol/L的氯化钠溶液,实际上配制的是1000mL 2mol/L的NaCl溶液,根据n=cV计算出氯化钠的物质的量,再根据m=nM计算出需要氯化钠的质量.
解答 解:实验室中没有950mL的容量瓶,在配制950mL 2mol/L的氯化钠溶液,实际上配制的是1000mL 2mol/L的NaCl溶液,
1000mL 2mol/L的NaCl溶液中含有氯化钠的物质的量为:2mol/L×1L=2mol,需要氯化钠的质量为:58.5g/mol×2mol=117g,
故答案为:117g.
点评 本题考查了物质的量浓度的计算、一定物质的量浓度的溶液的配制,题目难度不大,明确配制步骤为解答关键,注意掌握物质的量与物质的量浓度、摩尔质量之间的关系,试题培养了学生的化学计算、化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | X>Z>Y | B. | Z>Y>X | C. | X>Y>Z | D. | Z>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中共消耗1.75 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为1:4 | ||
| C. | 反应中共消耗65 g Zn | D. | 反应中共转移3.6 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+28.7 kJ/mol | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-28.7 kJ/mol | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ/mol | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| B. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 硝酸铵固体的溶解过程与焓变有关 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐和醋都是常用的食品添加剂 | |
| B. | 钙、铁、碘都是人体内必需的微量元素 | |
| C. | ClO2、O3等均可用于饮用水消毒 | |
| D. | 静脉滴注NaHCO3溶液可治疗水杨酸中毒反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用纤维素的水解产物制取乙醇 | |
| B. | 己烷(C6H14)有四种同分异构体 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
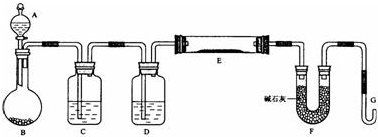
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
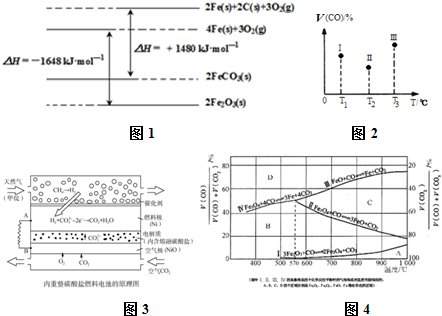
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com