
����Ŀ����ͼ��ʾ����װ����XΪ�����ӽ���Ĥ�����ѵĽṹ��ʽΪCH3OCH3�� 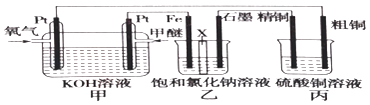
����Ҫ��ش�����������⣺
��1��д�������ĵ缫��Ӧ�� ��
��2������������Ҫ�������������ʯī�����������ɣ�
��3�������ͭ�к���п���������ʣ����ͭ�ĵ缫��ӦΪ���� ��
��4����Ӧһ��ʱ�䣬����ͭ��Һ��Ũ�Ƚ������������С�����䡱����
��5�����ڱ�״������2.24L�����μӷ�Ӧ����װ������������ͭ������Ϊ ��
��6��������װ�øij��ڱ�״���£���ʯī���缫������Ϊ2L��CuSO4��Һ��д�����CuSO4��Һʱ�����ӷ�Ӧ����ʽ��������ʵ�ʱ���Ͽ���Դ������ֻ�貹��22.2g����Cu2��OH��2CO3����ʹ���Һ�ָ���ԭŨ�����������ԭCuSO4��Һ��Ũ����mol/L����������Ƴ��ڶƼ��϶�ͭ��װ�ã�����θĶ������ü�Ҫ������������ ��
��7���������еĽ���Ĥȥ��������ֻ��H2�ݳ�������д���ҳ��з������ܷ�Ӧ�� ��
���𰸡�
��1��CH3OCH3��12e��+16OH���T2CO32��+11H2O
��2������
��3��Zn��2e��=Zn2+�� Cu��2e��=Cu2+
��4����С
��5��12.8g
��6��2Cu2++2H2O ![]() 2Cu+O2��+4H+��0.1����������ͭ�ijɴ�ͭ,��������ͭ�ijɶƼ�
2Cu+O2��+4H+��0.1����������ͭ�ijɴ�ͭ,��������ͭ�ijɶƼ�
��7��NaCl+H2O ![]() NaClO+H2��
NaClO+H2��
���������⣺��1����װ��Ϊȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�Ͷ��ȼ�ϵĵ缫�Ǹ����������ϼ���ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪ��CH3OCH3��12e��+16OH���T2CO32��+11H2O��
���Դ��ǣ�CH3OCH3��12e��+16OH���T2CO32��+11H2O����2����װ��Ϊ����Ȼ���װ�ã����缫����ԭ��صĸ�����Ϊ���ص�������ʯīΪ�����������������ӷŵ����������������������ӷŵ磬����������������������Ũ�ȴ���������Ũ����Һ�ʼ��ԣ�������װ������������������Ҫ�������������Դ��ǣ���������3�������ͭ�к���п���������ʣ������ϲ���ͭ����п����ʧ���ӽ�����Һ������������ͭ���ӣ������缫����ʽ�ֱ�ΪZn��2e��=Zn2+��Cu��2e��=Cu2+�����Դ��ǣ�Zn��2e��=Zn2+��Cu��2e��=Cu2+����4���ɣ�3�������缫����ʽ�ֱ�ΪZn��2e��=Zn2+��Cu��2e��=Cu2+������ת�Ƶ��������֪���������ܽ��ͭС��������������ͭ�����Ա�װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ���С��
���Դ��ǣ���С����5�����ݴ��������ת�Ƶ�������ȵ�������ͭ�Ĺ�ϵʽΪ��O2��������2Cu��������ͭ��������x��
O2�������������� | 2Cu |
22.4L | 128g |
2.24G | x |
x=12.8g��
���Դ��ǣ�12.8 g����6����ʯī���缫������Ϊ2L��CuSO4��Һ����ͭ�����������ᣬ���ӷ���ʽΪ��2Cu2++2H2O ![]() 2Cu+O2��+4H+������22.2gA��Cu2��OH��2CO3�������ʵ���Ϊ0.1mol������ʹ���Һ�ָ�ԭŨ�������������ͭԪ���غ��֪��n[CuSO4]=0.2mol��������ԭ��ҺCuSO4��Ũ����
2Cu+O2��+4H+������22.2gA��Cu2��OH��2CO3�������ʵ���Ϊ0.1mol������ʹ���Һ�ָ�ԭŨ�������������ͭԪ���غ��֪��n[CuSO4]=0.2mol��������ԭ��ҺCuSO4��Ũ���� ![]() =0.1molL��1����������Ƴ��ڶƼ��϶�ͭ��װ�ã���ͭ���������Ƽ������������Խ�������ͭ�ijɴ�ͭ����������ͭ�ijɶƼ����ɣ����Դ��ǣ�2Cu2++2H2O
=0.1molL��1����������Ƴ��ڶƼ��϶�ͭ��װ�ã���ͭ���������Ƽ������������Խ�������ͭ�ijɴ�ͭ����������ͭ�ijɶƼ����ɣ����Դ��ǣ�2Cu2++2H2O ![]() 2Cu+O2��+4H+��0.1����������ͭ�ijɴ�ͭ����������ͭ�ijɶƼ�����7���������еĽ���Ĥȥ��������ֻ��H2�ݳ��������ɵ��������������Ƽ�����Ӧ�����Ȼ��ƺʹ������ƣ��ܷ�ӦΪ��NaCl+H2O
2Cu+O2��+4H+��0.1����������ͭ�ijɴ�ͭ����������ͭ�ijɶƼ�����7���������еĽ���Ĥȥ��������ֻ��H2�ݳ��������ɵ��������������Ƽ�����Ӧ�����Ȼ��ƺʹ������ƣ��ܷ�ӦΪ��NaCl+H2O ![]() NaClO+H2�������Դ��ǣ�NaCl+H2O
NaClO+H2�������Դ��ǣ�NaCl+H2O ![]() NaClO+H2����
NaClO+H2����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��ˮ����Ĵ������ḻ��Լռ�������ܴ�������99%�������С�����Ԫ�ء�֮�ƣ���ˮ���庬��Ϊ65 mg��L��1����������SO2���շ������������£�

(1)����۵����ӷ���ʽ�� _________________________________________________��
(2)�������������������õ�Һ������ˮ�Ļ������������ǵ�����ܶ����ܴ���ص���з��롣����������������________��
(3)��ˮ������������һ����������������ڲ�����пɽ��������������ͨ��________(���Լ�����)��Һ���Գ�ȥ������
(4)����ݵ���������У��¶�Ӧ������80��90 �档�¶ȹ�����Ͷ������������������ԭ��______________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20.0g NaOH��ϡ��Һ��ϡ������ȫ��Ӧʱ���ų�28.7kJ����������ʾ�÷�Ӧ���Ȼ�ѧ����ʽ��ȷ���ǣ�������
A.NaOH��aq��+HNO3��aq��=NaNO3��aq��+H2O��l����H=+28.7kJmol��1
B.NaOH+HNO3=NaNO3+H2O��H=��28.7kJmol��1
C.NaOH��aq��+HNO3��aq��=NaNO3��aq��+H2O��l����H=��57.4kJmol��1
D.NaOH��aq��+HNO3 ��aq��=NaNO3 ��aq��+H2O��l����H=��57.4 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ʵ��ǣ� ��
A. ˮ B. ������ C. ������ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺ I���������ʵ�����A��B��Ϸ���2L���ܱ������У�������Ӧ3A��g��+B��g��xC��g��+2D��g������5min��ﵽƽ�⣬ƽ��ʱ���D��Ũ��Ϊ0.5mol/L��c��A����c��B��=3��5��v��C��=0.1mol/��Lmin������
��1��x= ��
��2��ǰ5min��B�ķ�Ӧ����v��B��= ��
��3��ƽ��ʱA��ת����Ϊ ��
��4��II��ˮ����ͨ�����ȵ�̼�㷢����Ӧ��C��s��+H2O��g��CO��g��+H2��g����H�� ��֪��K��300�棩��K��350�棩����÷�Ӧ���ȷ�Ӧ��
��5��������Ӧ��t0ʱ�̴ﵽƽ�⣬��t1ʱ�̸ı�ijһ����������Ӧ���ʣ���������ʱ��ı仯����ͼ��ʾ�������Ӧ�ı�ţ� 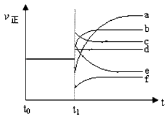
����С��������� �ڽ����¶�
��6����֪��Ӧ��CO��g��+CuO��g��CO2��g��+Cu��s����H2��g��+CuO��g��Cu��s��+H2O��g�� ����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2 �� ���¶��·�ӦCO��g��+H2O��g��CO2��g��+H2��g����ƽ�ⳣ��K=����K1��K2��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������η���E��ֱ���ͷ���G��Ӧ�������������η���L��ֱ���ͷ���M�������E���ӵ�Ԫ�ص�ԭ������С��10�����G���ӵ�Ԫ��Ϊ�������ڵ�Ԫ�أ�����ͼ���������ж�����ȷ���ǣ������� 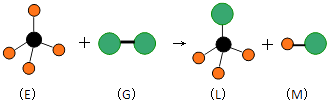
A.���³�ѹ�£�L��һ��Һ̬�л���
B.E��һ�ֺ��зǼ��Լ��ķ���
C.�����G ��Ư����ɫ����
D.������Ӧ��������ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���ϩ��˵������ȷ���ǣ�������
A.��ϩʹ��ˮ�����Ը��������Һ��ɫԭ����ͬ
B.��ϩ����������ԭ�Ӷ���ͬһ��ƽ���ϣ���̼���֮��ļ���ԼΪ 120��
C.��ȥ���������е���ϩ���Խ��������ͨ��ʢ���������Ը��������Һ��ϴ��ƿ
D.��ϩ�ͻ����飨 ![]() ���ķ�����ɷ���ͨʽ CnH2n �� �����������ͬϵ��
���ķ�����ɷ���ͨʽ CnH2n �� �����������ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Li��SO2��ؾ���������ʸߺ͵������ܺõ��ص㣮��������LiBr���ܼ���̼���ϩ�������棬��ط�ӦΪ2Li+2SO2 ![]() Li2S2O4 �� ����˵����ȷ���ǣ�������
Li2S2O4 �� ����˵����ȷ���ǣ�������
A.�õ�ط�ӦΪ���淴Ӧ
B.�ŵ�ʱ��Li+���ƶ�
C.���ʱ��������ӦʽΪLi++e���TLi
D.�õ�صĵ������Һ���Ի���LiBr��ˮ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������;��˵������ȷ���ǣ�������
A.������������ˮ��
B.�������������Ѭ����˿
C.̼�����ƿ���������θ�����
D.þ���Ͻ�������ƽ����Ŵ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com