
| 时间 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
| △c |
| △t |
| 0.06mol/L |
| 0.1mol/L |
| 0.03mol/L |
| 20S |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
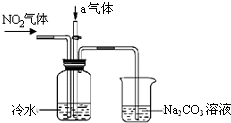 某课外小组模拟工业流程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护).
某课外小组模拟工业流程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护).查看答案和解析>>
科目:高中化学 来源: 题型:
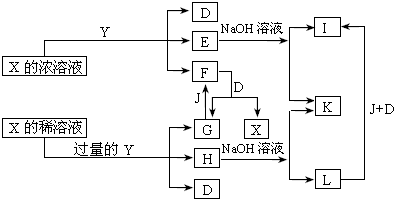
查看答案和解析>>
科目:高中化学 来源: 题型:
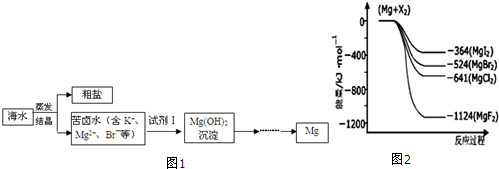
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+ |
| B、一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+ |
| C、c (Clˉ) 为 4.00 mol?L-1,c (Al3+) 为1.00 mol?L-1 |
| D、c (Mg2+) 为 1.00 mol?L-1,c(Na+ ) 为 0.50 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌跟稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率 |
| B、镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
| C、为保护海轮的船壳,常在船壳外面镶上锌块 |
| D、化学电源的能量来源于氧化还原反应所释放的化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com