
【题目】设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
A.常温常压下,8gCH4中含有的氢原子数为2NA
B.含有NA个氦原子的氦气在标准状况下的体积约为22.4L
C.常温常压下,48氧气和臭氧(O3)混合物中所含氧原子总数为3NA
D.物质的量浓度为0.5 molL﹣1的MgCl2溶液中,含有Cl﹣个数为1NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知合金A由两种常见金属组成.为测定其组成,某同学的实验流程如图所示: 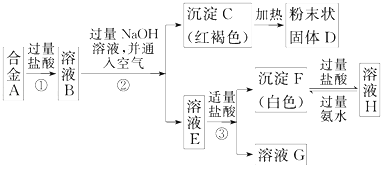
请回答:
(1)过程②中分离C和E的化学实验基本操作是;
(2)溶液H中所含的阳离子有(用离子符号表示);
(3)合金A与D在高温下反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,吸收的热量用于克服分子间作用力的是
A. 加热金属铝使之熔化B. 液氨受热蒸发
C. 加热碘化氢气体使之分解D. 加热硅晶体使之熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在C2H2、C6H6、C2H4O组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数是( )
A.92.3%
B.87.6%
C.75%
D.84%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4H2O+NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是
;
实验二:制取水合肼(实验装置如图所示)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充 分反应.加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分.(已知:N2H4H2O+2NaClO=N2↑+3H2O+2NaCl)
(2)分液漏斗中的溶液是(填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是
实验三:测定馏分中肼含量
水合肼具有还原性,可以生成氮气.测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液.
b.移取25.00mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右.记录消耗碘的标准液的体积.
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是
(4)滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”);若本次滴定消耗碘的标准溶液为18.00mL,馏分中水合肼(N2H4H2O)的质量分数为(保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是: . 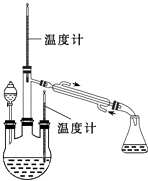
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要用密度为1.17g/cm3 , 溶质质量分数为36.5%的浓盐酸配制80mL1.0molL﹣1稀盐酸溶液.请回答下列问题:
(1)完成本实验所必需用到的仪器有:量筒、烧杯、玻璃棒、、 .
(2)所用浓盐酸的物质的量浓度;需用量筒量取浓盐酸mL.
(3)下列操作会使所配溶液浓度偏低的是 .
A.量取浓盐酸读数时,仰视刻度线
B.倒出量筒内的液体后,没有洗涤量筒
C.转移前,容量瓶中含有少量蒸馏水
D.将未冷却的溶液沿玻璃棒注入容量瓶中
E.定容时,仰视刻度线
F.定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.由于乳酸( ![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C.HF的稳定性很强,是因为其分子间能形成氢键
D.由图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子 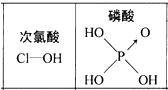
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com