
| A. | 牺牲阳极的阴极保护法利用的是原电池原理 | |
| B. | Fe2+能与[Fe(CN)6]3-反应生成带有特征蓝色的沉淀 | |
| C. | 电解质溶液的导电过程一定是电解质溶液的电解过程 | |
| D. | 如果在1.0L Na2CO3溶液中溶解0.010mol的BaSO4,则Na2CO3溶液的最初浓度不得低于0.24 mol/L[已知Ksp(BaSO4)=1.1×10-10; Ksp(BaCO3)=2.6×10-9] |
分析 A.在原电池中正极被保护,负极被腐蚀;
B.Fe2+能与[Fe(CN)6]3-反应生成Fe3[Fe(CN)6]2沉淀;
C.电解质溶液的导电时,阴阳离子在电极上放电;
D.发生反应为CO32-+BaSO4?BaCO3+SO42-,结合溶解平衡表达式计算出碳酸钠的浓度.
解答 解:A.在原电池中正极上溶液中的离子得电子,正极的电极材料不反应,即正极被保护,负极失电子被腐蚀,属于牺牲阳极的阴极保护法,故A正确;
B.Fe2+能与[Fe(CN)6]3-反应生成Fe3[Fe(CN)6]2沉淀,Fe3[Fe(CN)6]2属于蓝色沉淀,故B正确;
C.电解质溶液的导电时,阴离子在阳极上失电子,阳离子在阴极上得电子,所以电解质溶液的导电过程一定是电解质溶液的电解过程,故C正确;
D.碳酸钠与硫酸钡反应转化成碳酸钡的反应为:CO32-+BaSO4?BaCO3+SO42-,该反应的平衡常数为:K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=$\frac{1.1×1{0}^{-10}}{2.6×1{0}^{-9}}$=0.0423,
0.010molBaSO4完全溶解生成n(SO42-)=0.01mol,c(SO42-)=$\frac{0.01mol}{1L}$=0.01mol/L,所以c(Na2CO3)=c(CO32-)=$\frac{0.01}{0.0423}$≈0.24mol/L,所以Na2CO3溶液的最初浓度不得低于(0.24+0.01 )=0.25mol/L,故D错误.
故选D.
点评 本题考查比较综合,题目涉及原电池原理、亚铁离子的检验、电解原理的应用、化学平衡常数的有关计算,注意把握化学平衡常数的计算方法,题目难度中等,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | K(HF)=7.2×10-4 | B. | K(HNO2)=4.9×10-10 | ||
| C. | 反应NaCN+HF═HCN+NaF可以发生 | D. | K(HCN)<K(HNO2)<K(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量 | B. | 相对原子质量 | ||
| C. | 物质的摩尔质量 | D. | 12g12C中所含有的C原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
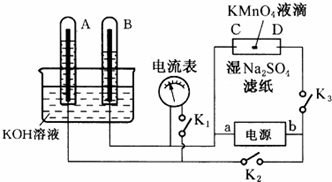
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
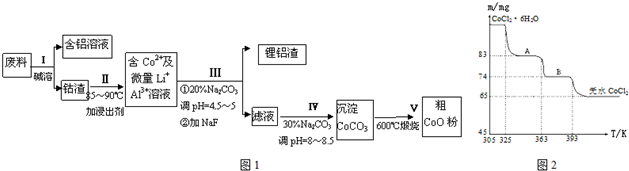
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素形成的单核阴离子还原性强于X | |
| B. | Z元素的简单气态氢化物的沸点比Y高 | |
| C. | W元素氧化物对应的水化物的酸性一定强于Z | |
| D. | X的气态氢化物可与其最高价含氧酸反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①④ | C. | ③⑥ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com