
 如图(尚有部分仪器未画出),有一容积为300mL的注射器与蒸馏烧瓶(500mL)相连(标准状况).向烧瓶中加入0.384g Cu和18mL2.5mol/L稀硝酸溶液,并立即用锡箔包住橡皮塞封住烧瓶口.试回答:
如图(尚有部分仪器未画出),有一容积为300mL的注射器与蒸馏烧瓶(500mL)相连(标准状况).向烧瓶中加入0.384g Cu和18mL2.5mol/L稀硝酸溶液,并立即用锡箔包住橡皮塞封住烧瓶口.试回答:分析 (1)硝酸可腐蚀橡胶塞;
(2)铜和稀硝酸反应生成硝酸铜、一氧化氮和水,一氧化氮和氧气反应;
(3)n(Cu)=$\frac{0.384g}{64g/mol}$=0.006mol,n(HNO3)=2.5mol/L×0.018L=0.045mol,发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,由方程式可知硝酸过量,3n(Cu)~2n(HNO3)被还原,由此分析解答;
(4)空气总体积为800mL,氧气体积为800mL×20%=160mL,物质的量约为$\frac{0.16L}{22.4L/mol}$=0.0071mol,n(Cu)=$\frac{0.384g}{64g/mol}$=0.006mol,结合电子的转移判断;
解答 解:(1)硝酸可腐蚀橡胶塞,应用锡箔包住,故答案为:防止橡胶塞被硝酸腐蚀(氧化);22.4L/mol
(2)铜和稀硝酸反应生成硝酸铜,溶液变蓝,生成一氧化氮和水,可观察到有气泡生成,一氧化氮和氧气反应,气体逐渐变成红棕色,反应由慢到快,活塞后退;
故答案为:①Cu片溶解 ②产生无色气体 ③上部变为红棕色 ④溶液变蓝 ⑤反应由慢到快 ⑥活塞后退;
(3)n(Cu)=$\frac{0.384g}{64g/mol}$=0.006mol,n(HNO3)=2.5mol/L×0.018L=0.045mol,发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,由方程式可知硝酸过量,3n(Cu)~2n(HNO3)被还原,所以被还原的硝酸为0.006mol×$\frac{2}{3}$=0.004mol,故答案为:0.004mol;
(4)n(Cu)=$\frac{0.384g}{64g/mol}$=0.006mol,n(HNO3)=2.5mol/L×0.018L=0.045mol,发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,由方程式可知硝酸过量,铜完全反应,
铜失去电子的物质的量为0.006mol×2=0.012mol,可生成n(NO)=$\frac{2}{3}$×0.006mol=0.004mol,与氧气发生4NO+3O2+2H2O=4HNO3,
则需要(O2)=0.004mol×$\frac{3}{4}$=0.003mol,V(O2)=0.003mol×22.4L/mol=0.0672L=672mL,
而空气总体积为800mL,氧气体积为800mL×20%=160mL,则停止反应后,轻轻推拉注射器活塞,使气体与气体,气体与液体皆充分反应,氧气不足,有NO剩余,
所以最终溶液中NO3-的物质的量浓度与开始时相比变小,
故答案为:变小.
点评 本题考查物质的性质探究,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,易错点为(4),注意结合反应的方程式计算.


科目:高中化学 来源: 题型:解答题

 .
. .
. $→_{②Zn/H_{2}O}^{①O_{3}}$
$→_{②Zn/H_{2}O}^{①O_{3}}$ +R3CHO,
+R3CHO, 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓H_{2}SO_{4}△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓H_{2}SO_{4}△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
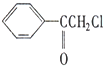 中国是《日内瓦协定书》的缔约国,反对使用化学武器,反对任何形式的化学武器扩散.苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式为:
中国是《日内瓦协定书》的缔约国,反对使用化学武器,反对任何形式的化学武器扩散.苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式为: 、
、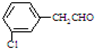 、
、 、
、 、还有
、还有 或
或 (任写一个合理结构).
(任写一个合理结构). 与溴水充分反应,需消耗4mol单质溴;
与溴水充分反应,需消耗4mol单质溴; 与氢气完全加成后的产物的结构简式
与氢气完全加成后的产物的结构简式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
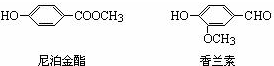
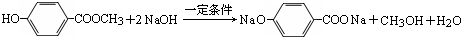 .
.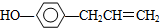 ,下列叙述中正确的是A(填序号)
,下列叙述中正确的是A(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁元素在反应①中被氧化,在③中被还原 | |
| B. | 反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 | |
| C. | 氧化性强弱顺序为:Cl2>I2>Br2>Fe3+ | |
| D. | 还原性强弱顺序为:I->Fe2+>Br->Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com