
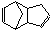
 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中.科目:高中化学 来源: 题型:
| A、标准状况下,33.6L HF中含有氟原子的数目为1.5NA |
| B、1L 0.1mol/L的碳酸钠溶液中的阴离子总数等于0.1NA |
| C、30g SiO2中有0.5NA个[SiO4]四面体 |
| D、某密闭容器中盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
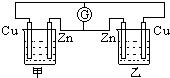 在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )
在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )| A、电流计G的指针不动 |
| B、通过电流计G的电子流动方向是由下向上 |
| C、甲、乙两装置都不是电解槽 |
| D、甲装置中铜极上有气泡产生,乙装置中,[H+]会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 40 |
| 2 |
| 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 运用化学反应原理研究部分单质及其化合物的反应有重要意义.
运用化学反应原理研究部分单质及其化合物的反应有重要意义.| 1 |
| 2 |
c(C
| ||
c(S
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
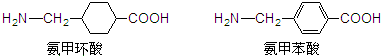
| A、氨甲环酸、氨甲苯酸都既能溶于盐酸,又能溶于NaOH溶液 |
| B、氨甲苯酸属于芳香族α-氨基酸的同分异构体和苯丙氨酸互为同系物 |
| C、氨甲环酸、氨甲苯酸都能发生取代、氧化、缩聚、加成等反应 |
| D、氨甲环酸、氨甲苯酸中各有5种不同的氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硝酸 | B、稀硫酸 |
| C、盐酸 | D、浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾溶液中滴加过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| B、醋酸溶液与Mg(OH)2反应:Mg(OH)2+2H+═Mg2++2H2O |
| C、小苏打溶液中加足量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| D、SO2通入FeCl3溶液中:SO2+Fe3++2H2O═SO42-+Fe2++4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com