
| A、溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3-)>c(Cl-)>c(I-)>c(Ag+) |
| B、溶液中先产生的是AgI沉淀 |
| C、AgCl的KSP的数值为1.69×10-10 |
| D、若在AgI悬浊液中滴加一定量的KCl溶液,黄色沉淀会转变成白色沉淀 |


科目:高中化学 来源: 题型:
| A、凯库勒--苯的发现和提出苯分子结构学说 |
| B、科里--提出有机合成逆合成分析原理 |
| C、门捷列夫--由无机物合成有机物,打破了有机物的生命力学说 |
| D、阿伏加德罗--提出原子-分子学说 |
查看答案和解析>>
科目:高中化学 来源: 题型:
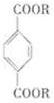 某种对苯二甲酸酯常用作塑料增塑剂,其结构简式如图所示.(R表示相同的烃基)
某种对苯二甲酸酯常用作塑料增塑剂,其结构简式如图所示.(R表示相同的烃基)

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,0.1molCl2溶于水,转移的电子数目为0.2NA |
| B、常温常压下,18gH2O中含的质子数为10NA |
| C、标准状况下,11.2LCH2Cl2中含有的分子数目为0.5NA |
| D、常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH
| ||
| B、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) | ||
C、室温下向10 mL pH=3的醋酸溶液中加水稀释,溶液中
| ||
| D、在0.1 mol?L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠溶液和稀硝酸反应 |
| B、氨水和稀盐酸反应 |
| C、Ba(OH)2溶液滴入稀硫酸中 |
| D、二氧化碳通入澄清石灰水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 2min末浓度/mol?L-1 | 0.08 | a | b |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、平衡时,X的转化率为20% |
| B、t℃时,该反应的平衡常数为40 |
| C、增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 |
| D、前2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使甲基橙变黄的溶液中:Na+、K+、SO42-、Al3+ |
| B、pH=2的溶液中:Na+、ClO-、NH4+、SO42- |
| C、某透明澄清的溶液中:NH4+、Cu2+、NO3-、Cl- |
| D、0.1 mol?L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是中学化学中某些物质之间的相互转化关系.已知C、D、G、H、K为单质,其他为化合物;A是一种常见的液态化合物,J为淡黄色固体,E对玻璃具有很强的腐蚀性;G、K是碳素钢中的两种重要元素,其中K含量少;E、F对应溶液的酸碱性相反,F的焰色反应为黄色.请按要求作答:
如图是中学化学中某些物质之间的相互转化关系.已知C、D、G、H、K为单质,其他为化合物;A是一种常见的液态化合物,J为淡黄色固体,E对玻璃具有很强的腐蚀性;G、K是碳素钢中的两种重要元素,其中K含量少;E、F对应溶液的酸碱性相反,F的焰色反应为黄色.请按要求作答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com