
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤对电子数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是____________(写分子式),它们的稳定性由弱到强的顺序是_______________________________________________________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)C的单质分子中存在________个π键、________个σ键。
【解析】 短周期中族序数等于周期数的非金属元素只有H,故A为H;由B元素原子的得失电子能力可判断B为C,其1s、2s、2p轨道各有2个电子;C元素的价电子构型为nsnnpn+1,由s轨道容纳2个电子可知n只能等于2,故C为N;由最外层电子数与电子层数的关系可知D为O;由E在地壳中含量可知其为Fe。(1)C、O形成的非极性分子为CO2,中心原子为碳原子,由电子式可知其中心原子无孤对电子,CO2为直线形分子,采用sp杂化方式。(2)H与C、N、O形成的10电子分子为CH4、NH3、H2O,常温下水为液态,沸点最高,其次为NH3,CH4沸点最低;同周期元素从左到右,氢化物的稳定性逐渐增强,故稳定性顺序为CH4<NH3<H2O。(3)HCN的结构式可以表示为H—C≡N,空间构型是直线形;CH2O的结构式为 ,碳原子采取sp2杂化,故为平面三角形结构。(4)同周期元素从左到右,电负性逐渐增强,故电负性关系为C<N<O;同周期元素从左到右,第一电离能基本呈现逐渐增大的趋势,但由于N的p轨道电子处于半充满状态,第一电离能较大,故第一电离能关系为C<O<N。(5)N2结构式为N≡N,其中含有2个π键、1个σ键。
,碳原子采取sp2杂化,故为平面三角形结构。(4)同周期元素从左到右,电负性逐渐增强,故电负性关系为C<N<O;同周期元素从左到右,第一电离能基本呈现逐渐增大的趋势,但由于N的p轨道电子处于半充满状态,第一电离能较大,故第一电离能关系为C<O<N。(5)N2结构式为N≡N,其中含有2个π键、1个σ键。
【答案】 (1)0 sp杂化 (2)H2O、NH3、CH4 CH4、NH3、H2O (3)直线形 平面三角形 (4)O>N>C N>O>C
(5)2 1


科目:高中化学 来源: 题型:
下列物质的转化在给定条件下能实现的是( )
①Al2O3 NaAlO2(aq)
NaAlO2(aq)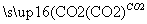 Al(OH)3
Al(OH)3
②S SO3
SO3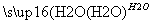 H2SO4
H2SO4
③饱和NaCl(aq)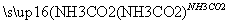 NaHCO3
NaHCO3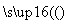 Na2CO3
Na2CO3
④Fe2O3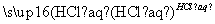 FeCl3(aq)
FeCl3(aq)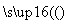 无水FeCl3
无水FeCl3
⑤MgCl2(aq)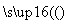 Mg(OH)2
Mg(OH)2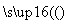 MgO
MgO
A.①③⑤ B.②③④
C.②④⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
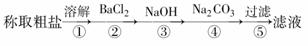

(1)判断BaCl2已过量的方法是__________________________________。
(2)第④步中,相关的化学方程式是_______________________________________。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解( ) B.天平的砝码已锈蚀( )
C.定容摇匀时,液面下降又加水( ) D.定容时俯视刻度线( )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理、方法和结论都正确的是( )
A.用HNO2溶液做导电性实验,灯光较暗,说明HNO2是弱电解质
B.在滴有酚酞的Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡
C.将等体积、等pH的盐酸和醋酸溶液分别稀释相同倍数,醋酸溶液的pH变化大
D.利用溶解性的不同,可用酒精将碘水中的碘萃取出来
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.原子核外电子层数越多,原子半径越大
B.每一主族所含非金属元素的种类可表示为︳族序数-2
C.根据泡利原理将氧元素基态原子的电子排布图书写为

D.C2H2分子中的碳采取sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
反兴奋剂是每届体育赛事关注的热点。利尿酸是一种常见的兴奋剂,其分子结构如下:

关于利尿酸的说法中,正确的是( )
A.它是芳香烃
B.它不能使酸性高锰酸钾溶液褪色
C.它不能与饱和碳酸钠溶液反应放出CO2
D.它能发生取代反应、加成反应和酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl混合而成,为检验它的成分,做了如下实验:
①将固体混合物溶于水,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
则该固体混合物中( )
A.肯定有Na2SO4,可能有CuSO4
B.一定有NaCl,肯定没有Na2SO4
C.一定有Na2CO3,可能有NaCl
D.可能有CaCl2,一定没有CuSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com