
【题目】A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)A在周期表中的位置是 。AFD的电子式为 。
(2) BD2的结构式为 ; BD2形成晶体的类型为 。
(3)元素D、E 、F形成的简单离子的半径由大到小为 (用离子符号表示)。
(4)写出实验室制备单质F的离子方程式 。
(5)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式 。
【答案】(1)第一周期IA族 ![]() ;
;
(2)![]() ,分子晶体;(3)Cl﹣>O2—>Na+ ;
,分子晶体;(3)Cl﹣>O2—>Na+ ;
(4)MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;(5)2Na2O2+2H2O=4NaOH+O2↑。
Mn2++Cl2↑+2H2O;(5)2Na2O2+2H2O=4NaOH+O2↑。
【解析】
试题分析:根据题意知A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,则A为氢元素;B的最外层电子数是其所在周期数的2倍,则B为碳元素;碳单质在氧气中充分燃烧能生成CO2,则D为氧元素;E+与D2-具有相同的电子数,则E为钠元素;A单质在F单质中燃烧,产物溶于水得到一种强酸,则F为氯元素。
(1)氢元素在周期表中的位置是第一周期IA族;HClO的电子式为![]() 。
。
(2)CO2 的结构式为![]() ; 形成晶体的类型为分子晶体。
; 形成晶体的类型为分子晶体。
(3)电子层数越多,离子半径越大,电子层结构相同的离子,核电荷数越大,离子半径越小,故简单离子的半径由大到小为Cl﹣>O2—>Na+ 。
(4)实验室利用二氧化锰和浓盐酸共热制备氯气,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(5)钠与氧形成的既含离子键又含共价键的化合物为过氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
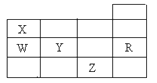
A. 常压下五种元索的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物沸点比X的氢化物的沸点高
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式能够很直接形象的表示化学反应的过程与特征的一种符号,书写化学方程式是我们必须掌握的一项基本技能。请按照要求完成下列方程式。
I.生活中很多现象和原理都可以用化学反应来解释:
(1)写出泡沫灭火器反应原理的离子方程式: 。
(2)用ClO2进行饮用水处理比使用Cl2具有很高的优越性,不仅杀菌消毒效率高,不产生致癌的有机氯化物,而且还能除去水中的Fe2+、Mn2+。请写出ClO2除去饮用水中Mn2+的离子反应方程式(已知Mn2+转变为MnO2, ClO2转变为ClO2-) 。
II.根据体系中的物质及物质的性质,我们可以推测出该体系所发生的变化,并能用方程式写是出来:
(1)某一反应体系有反应物和生成物共六种物质:N2O、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。写出该反应的化学方程式: 。
(2)将NaClO溶液逐滴滴入含淀粉的NaI溶液中,溶液变蓝,继续滴加,溶液顺色先加深,后逐渐变浅,最终消失。经检测得知此时溶液中含有一种含正五价元素的含氧酸根。写出上述变化过程的两个离子反应方程式 、 。
III.给化学反应分类是为了更好的研究反应的规律与特征,有利于我们把握反应的本质。置换反应是常见反应类型之一,其通式可以表示为:单质(l)十化合物(l)= 化合物(2)十单质(2)。请写出满足以下要求的2个有金属单质参与的置换反应化学方程式:①所涉及的元素都是短周期元素;② 4种单质分属4个不同的主族: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列有关说法正确的是
A. 化学危险品易危害人类,应禁止生产
B. 汽车尾气是目前城市大气污染产生的一个重要来源
C. 氢氧化钠和氢氧化铝都可用于治疗胃酸过多
D. 漂白粉长期放置在空气中不会变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )
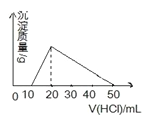
A.0.25mol/L B.0.5 mol/L C.2mol/L D.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途说法不正确的是
A. FeCl3易溶于水,可用作净水剂
B. 硅是半导体材料,纯净的硅是光纤制品的基本原料
C. 浓硫酸能干燥氯气,说明浓硫酸具有吸水性
D. 氨易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点﹣129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式: .
(2)NF3的沸点比NH3的沸点(﹣33℃)低得多的主要原因是 .
(3)NF3中N元素采取 方式杂化.
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为 其中心离子是,配位数为 .
(5)已知氧族元素(氧O、硫S、硒Se、碲Te),工业上可用Al2Te3来制备H2Te,完成下列化学方程式:
Al2Te3+ ═ Al(OH)3↓+ H2Te↑
(6)已知在常温下,生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式 .
(7)如图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应的反应热.则:b代表 ,d代表 (均写单质名称).
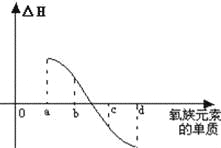
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的原子结构决定其性质和周期表中的位置.下列说法正确的是( )
A. 元素原子的最外层电子数等于元素的最高化合价
B. 多电子原子中,在离核较近的区域内运动的电子的能量较高
C. P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
D. 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.NH4Fe(SO4)2加入过量NaOH溶液中:NH4++Fe3++4OH-=NH3![]() H2O+Fe(OH)3↓
H2O+Fe(OH)3↓
B.次氯酸钠溶液中通入过量的二氧化硫:ClO-+SO2+H2O=HSO3-+HClO
C.Ba(OH)2溶液和稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com