
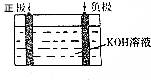
 甲醇(CH3OH)是一种常见有机物,有重要的应用.
甲醇(CH3OH)是一种常见有机物,有重要的应用.分析 (1)燃料燃烧时化学能转化为热能,反应中得电子的物质为氧化剂;
(2)燃料电池中燃料在负极失电子,电解质溶液中阴离子向负极移动,根据甲醇与电子之间的关系计算;
(3)1kW•h=3600kJ,n(H2O)=$\frac{b}{18}$mol,则放出的热量为$\frac{b}{18}$×akJ=$\frac{ab}{18}$kJ,据此分析.
解答 解:(1)甲醇作燃料燃烧的化学方程式为2CH3OH+3O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2+4H2O,甲醇在燃烧时化学能转化为热能,反应中氧气得电子作氧化剂;
故答案为:化学能转化为热能;O2;
(2)燃料电池中燃料在负极失电子,则负极通入的是CH3OH,电解质溶液中阴离子向负极移动,即溶液中的OH-移向负极移动;负极电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,则2mol甲醇转移电子为12mol,即转移电子数为12NA;
故答案为:CH3OH;12NA;
(3)1kW•h=3600kJ,n(H2O)=$\frac{b}{18}$mol,则放出的热量为$\frac{b}{18}$×akJ=$\frac{ab}{18}$kJ,该电池的能量转化率为$\frac{3600kJ}{\frac{ab}{18}kJ}$=$\frac{64800}{ab}$;
故答案为:$\frac{64800}{ab}$.
点评 本题考查了化学反应中的能量变化、氧化还原反应、原电池原理的应用和电子转移的计算,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握氧化还原反应的基本概念和电极方程式的书写.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
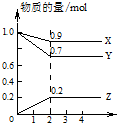 某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.由图中数据分析.
某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.由图中数据分析.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
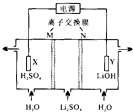
| A. | N为阳离子交换膜 | |
| B. | X电极连接电源负极 | |
| C. | 制备2.4 g LiOH产生2.24 L H2(标况) | |
| D. | Y电极反应式为O2+2H2O+4e一=40H- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2=CH2 | B. | 醋酸的分子式:CH3COOH | ||
| C. | 丙烷的比例模型: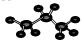 | D. | 乙酸甲酯的结构式:CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中Na+、K+、NO${\;}_{3}^{-}$、Cl-可大量共存 | |
| B. | 向溶液中通入CO2气体可以增强溶液漂白性 | |
| C. | 和浓盐酸反应的离子方程式:Cl-+ClO-+2H+=Cl2↑+H2O | |
| D. | 通入过量SO2气体反应的离子方程式:SO2+ClO-+Ca2++H2O=CaSO4↓+Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
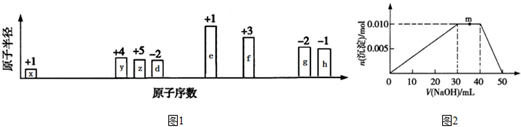
 (或
(或
 等);
等);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com